Капніть лимонний сік на язик – і ось вона, гостра кислинка, що змушує слизову скоротитися в захваті чи подиві. Ця знайомая відчуття ховає в собі есенцію кислот: речовин, які в водному розчині віддають протони, знижуючи pH нижче 7 і запускаючи безліч реакцій. Від соляної кислоти в шлунку, що розщеплює їжу, до сірчаної в акумуляторах електрокарів – кислоти пронизують наше життя, як невидимі нитки долі.
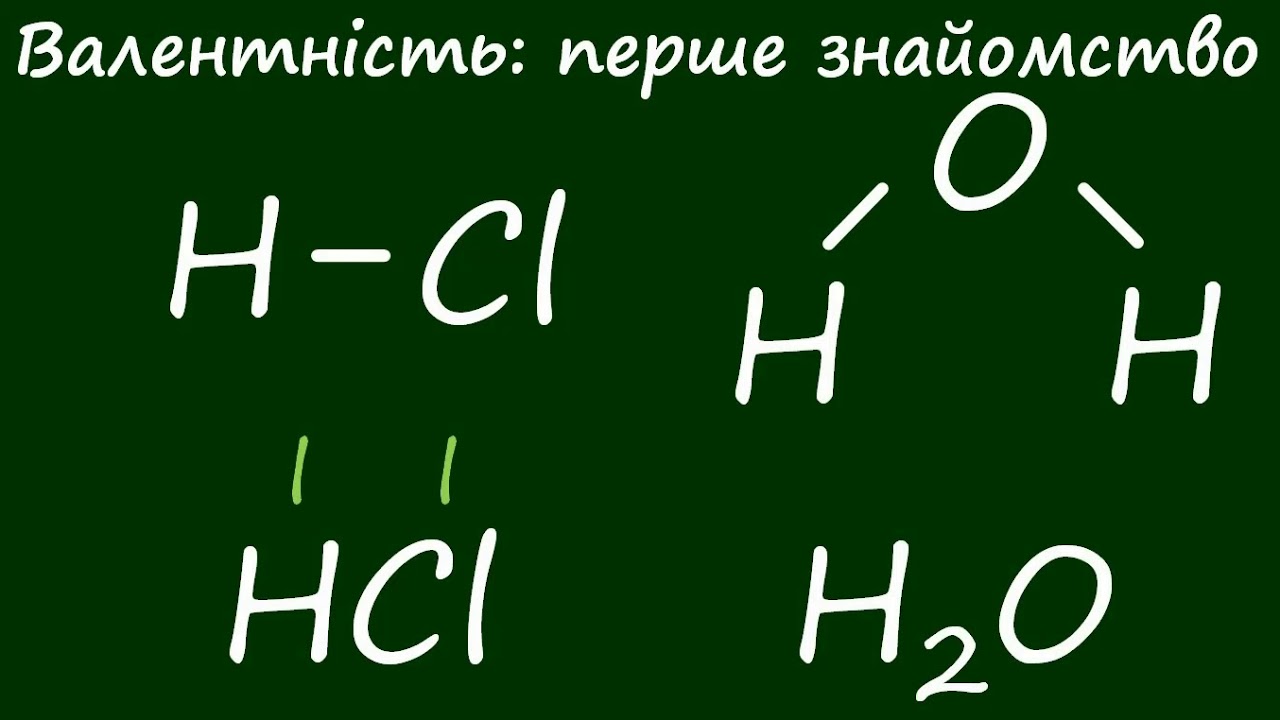
У класичному сенсі кислоти дисоціюють з утворенням іонів H⁺, реагуючи з основами на солі та воду. Але за сучасними теоріями вони ширші: донори протонів чи акцептори електронних пар. Розбавлена оцтова кислота освіжає салат, а концентрована сірчана – кородує сталь за хвилини. Ця подвійність робить їх героями хімії, де сила вимірюється не м’язами, а молекулами.
Щоб розібратися глибше, зануримося в еволюцію поняття. Кислоти не завжди були науковим терміном – вони народилися з алхімічних пошуків і перетворилися на інструмент прогресу.
Історія відкриття: від алхімії до наукової революції
Ще в античності люди помічали, як оцет роз’їдає вапняк чи як сірка в вулканах випускає їдкі пари. Але першим, хто чітко описав кислоти, став Роберт Бойль у 1661 році в книзі “Скептичний хімік”. Він визначив їх як речовини, що змінюють синій лакмус на червоний і розчиняють метали, кинувши виклик алхімікам з їхнім “філософським каменем”. Бойль, аристократ і мислитель, перетворив емпіричні спостереження на науку, де кислоти стали протилежністю щогам.
Антуан Лавуазьє, батько сучасної хімії, у 1780-х дав назву: від латинського “acidus” – кислий. Він пов’язав кислоти з киснем, вважаючи його ключовим елементом, хоч і помилявся. Джон Дальтон у 1808 з атомною теорією пояснив їх склад як водень плюс залишок. Кульмінація – 1884 рік, коли Сванте Арреніус запропонував теорію електролітичної дисоціації: кислоти дають H⁺ у воді. За це швед отримав Нобеля в 1903. Ці кроки перетворили кислоти з містики на точну науку.
Сучасні теорії кислотності: від протонів до електронів
Арреніусівське визначення обмежене водними розчинами, тож у 1923 році Йоганнес Бренстед і Томас Лоурі незалежно сформулювали ширшу модель: кислоти – донори протонів (H⁺), основи – акцептори. Наприклад, оцтова кислота CH₃COOH віддає H⁺ аніону ацетату CH₃COO⁻. Ця теорія працює скрізь, де є протонний обмін, навіть без води.
Гілберт Льюїс пішов далі: кислоти – акцептори електронних пар, основи – донори. BF₃ приймає пару від NH₃, утворюючи комплекс. Це охоплює неводні системи, як суперкислоти. Сила вимірюється константою дисоціації pKa: нижче 0 – сильні (HCl pKa -6,3), вище 4 – слабкі (оцтова 4,76). Суперкислоти, як HF-SbF₅ (pKa нижче -20), розчиняють скло й органіку, використовуються в нафтохімії.
pH = -log[H⁺] описує кислість: 0 – 1М HCl, 2 – лимонний сік. У 2025 році шкала розширена для нанотехнологій, де pH контролює ферменти в біосенсорах.
Класифікація кислот: різноманіття форм і сил
Кислоти поділяють за кількома критеріями, ніби фрукти на полиці: органічні й неорганічні, сильні й слабкі, кисневі й безкисневі. Неорганічні (мінеральні) – HCl, H₂SO₄ – промислові гіганти. Органічні – CH₃COOH, C₆H₈O₇ (лимонна) – у природі та їжі.
За вмістом оксигену: безоксигенові (HCl, HF – різкі, газоподібні) проти оксигеновмісних (HNO₃, H₃PO₄ – стабільніші). Основність: одноосновні (HCl), двоосновні (H₂SO₄, перша ступінь сильна, друга слабша), триосновні (H₃PO₄). Сила: сильні повністю дисоціюють (7 класичних: HCl, HBr, HI, HNO₃, H₂SO₄, HClO₄, H₂SO₄), слабкі – частково (HF pKa 3,17).
Ось таблиця для порівняння ключових типів:
| Тип кислоти | Приклади | pKa | Застосування |
|---|---|---|---|
| Сильні неорганічні | HCl, H₂SO₄, HNO₃ | < -3 | Акумулятори, добрива |
| Слабкі органічні | CH₃COOH, C₆H₈O₇ | 4-5 | Харчові добавки |
| Суперкислоти | HF-SbF₅ | < -20 | Органічний синтез |
Дані з uk.wikipedia.org та LibreTexts. Ця класифікація допомагає прогнозувати поведінку: сильні – агресивні, слабкі – м’які помічники.
Фізичні властивості: від рідин до кристалів
Більшість кислот – безбарвні рідини або кристали, з різним запахом: HCl – різкий, оцтова – знайомий оцетний. Густина варіюється: H₂SO₄ 1,84 г/см³, важча за воду. Температура кипіння висока через водневі зв’язки – HF 19,5°C, але H₃PO₄ тане при 42°C.
Розчинність у воді висока для більшості, але жироподібні органічні (олеїнова) пливуть плівкою. Концентровані випаровують тепло, пари подразнюють очі. Сильні кислоти корозійні, викликають опіки, бо зневоднюють тканини.
- Леткість: HCl газ, HNO₃ кипить при 83°C з розкладом.
- Колір: чисті безбарвні, але HNO₃ жовтіє від NO₂.
- Смак: кислий, але тільки слабкі безпечні (цитрусові).
Ці властивості диктують зберігання: у пластику чи склі, подалі від металів. У побуті оцтова 9% безпечна, промислові 98% – небезпечні.
Хімічні властивості: реакції, що змінюють світ
Кислоти реагують бурхливо: з основами нейтралізуються (HCl + NaOH → NaCl + H₂O), з основними оксидами (2HCl + CaO → CaCl₂ + H₂O), з металами ліворуч водню в ряду активності (Zn + 2HCl → ZnCl₂ + H₂↑). Нітратна окислює мідь: Cu + 4HNO₃ → Cu(NO₃)₂ + 2NO₂↑ + 2H₂O.
- Дисоціація: H₂SO₄ → 2H⁺ + SO₄²⁻ (повна перша ступінь).
- З індикаторами: лакмус червоніє, фенолфталеїн безбарвний.
- Каталіз: H⁺ прискорює етерифікацію.
У слабких ступенева: H₃PO₄ дає H₂PO₄⁻, потім HPO₄²⁻. Це створює буфери, стабілізуючи pH крові (7,4). Екологічно кислотні дощі (H₂SO₄ від SO₂) руйнують ґрунти, але нейтралізуються вапном.
Номенклатура кислот: як читати формули
Назви від залишку: безоксигенові – гид…идна (HCl – хлоридна). Кисневі: -атна для високої валентності (H₂SO₄ – сульфатна), -итна для нижчої (H₂SO₃ – сульфітна). Органічні: IUPAC – етанова (CH₃COOH), народні – оцтова.
Структурні формули показують зв’язки: H–O–SO₂–OH для H₂SO₄. Валентність залишку = основність. Це логіка, що полегшує запам’ятовування сотень сполук.
Застосування кислот: від кухні до космосу
Сірчана кислота – король хімії, 80 млн тонн/рік (2025 дані), для добрив (амфос), нафтоочищення. Хлоридна – травлення шлунка (0,1М), чистка металів. Фосфорна – кола (E338), зубна паста.
У косметиці AHA (гліколева) відлущують шкіру, BHA (саліцилова) борються з акне – ринок $15 млрд у 2025. Харчова: лимонна E330 регулює кислотність, консервує. Медицина: аскорбінова (віт C) антиоксидант, борна антисептик. Екологія: очищення стоків.
Цікаві факти про кислоти
Шлунок людини містить 1-2 л HCl на день – без нього голодна смерть. Флуоридна HF проникає через шкіру непомітно, руйнуючи кістки. Суперкислота fluoroantimonic може протонувати вуглеводні, створюючи “карбокатіони” для нових матеріалів. У 2025 NASA тестує кислотостійкі полімери для Марса. Оцтова кислота в комахах – мурашина, жалить як вогонь!
- Найслабша природна – щавлева в шпинаті.
- Найсильніша – в лабораторіях, розчиняє все.
Ці перлини показують, як кислоти грають у природі жорстко й красиво.
Кислоти оточують нас, додаючи гостроти смаку й сили реакціям, від простого салату до складних батарей. Їхня магія в балансі: надто багато – катастрофа, в міру – диво прогресу. Досліджуйте обережно, бо в їхньому світі сила ховається в протонах.












Залишити відповідь