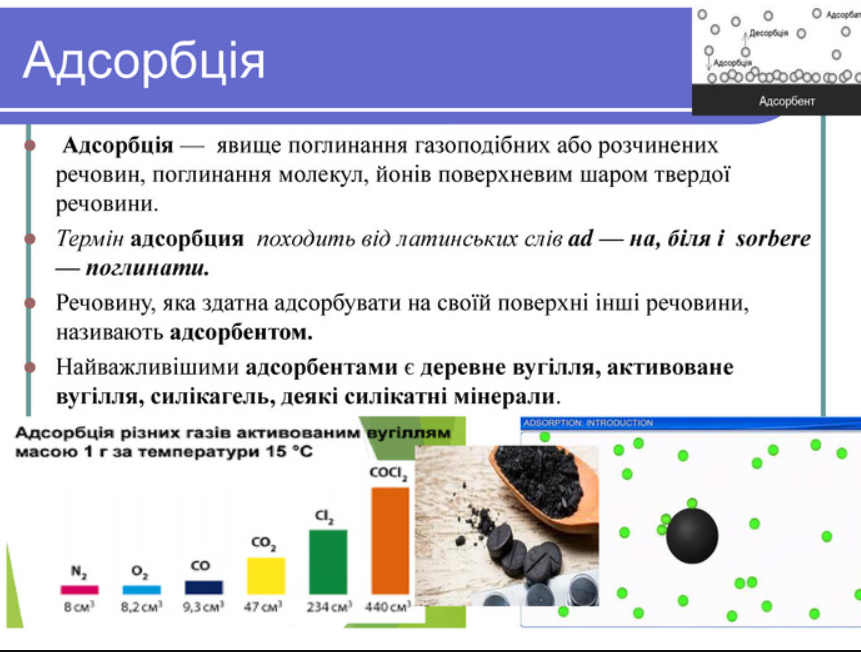
Адсорбція оживає в той момент, коли молекули газу чи рідини, ніби притягнуті невидимою силою, чіпляються за поверхню твердого матеріалу, утворюючи тонкий, але потужний шар. Це явище, де поверхня стає ареною для мікроскопічних взаємодій, поглинаючи речовини з навколишнього середовища без проникнення вглиб. Уявіть активоване вугілля, яке жадібно захоплює забруднювачі з води, роблячи її кришталево чистою – ось класичний прояв адсорбції в дії.
На відміну від повсякденних процесів, де речовини просто розчиняються, адсорбція фокусується виключно на поверхні, створюючи динамічну рівновагу між поглинанням і відпусканням. Це не просто науковий термін; це фундаментальний механізм, що лежить в основі очищення повітря в протигазах чи видалення токсинів у медицині. Згідно з даними uk.wikipedia.org, адсорбція визначається як вибіркове поглинання з газового чи рідкого середовища поверхневим шаром твердого тіла, і цей процес супроводжує людство з давніх часів, хоча науково осмислений лише в 18 столітті.
А тепер зануримося глибше, бо адсорбція – це не статичний факт, а жива симфонія взаємодій, де температура, тиск і природа матеріалів грають соло, визначаючи, наскільки міцно молекули триматимуться за поверхню. Цей процес не тільки пояснює, чому деякі матеріали “прилипають” до інших, але й відкриває двері до інновацій, від екологічного очищення до нанотехнологій.
Основні принципи адсорбції: як поверхні притягують молекули
Адсорбція починається з адсорбенту – твердого матеріалу з величезною поверхнею, часто пористого, як губка, готового захоплювати адсорбат, тобто речовину, що поглинається. Цей танець відбувається завдяки силам притягання: від слабких ван-дер-ваальсових взаємодій до міцних хімічних зв’язків. Поверхня адсорбенту, ніби магніт, притягує молекули, формуючи шар, товщина якого залежить від умов середовища.
Уявіть, як молекули аміаку чіпляються за поверхню силікагелю в промисловому фільтрі – це не випадковість, а результат енергетичної вигоди, коли система прагне мінімізувати вільну енергію. Згідно з термодинамікою, адсорбція часто екзотермічна, виділяючи тепло, що робить процес спонтанним при нижчих температурах. Але якщо нагріти систему, молекули можуть “відірватися”, запускаючи десорбцію – зворотний процес, який є ключем до регенерації адсорбентів.
Ця взаємодія не обмежується лабораторіями; вона пульсує в природі, де ґрунт адсорбує поживні речовини, допомагаючи рослинам рости. Детальніше розкриваючи, адсорбція характеризується величиною, що вимірюється в молях на грам або квадратний метр поверхні, і її інтенсивність зростає з пористістю матеріалу, роблячи активоване вугілля з його 500-1500 м²/г справжнім чемпіоном.
Відмінність адсорбції від абсорбції: поверхня проти об’єму
Адсорбція і абсорбція – близнюки, але з різними характерами: перша тримається за поверхню, ніби павутина, що ловить комах, тоді як друга проникає вглиб, ніби вода, що просочує губку. У адсорбції молекули утворюють шар на межі фаз, не змінюючи внутрішню структуру адсорбенту, що робить процес зворотним і поверхневим. Абсорбція ж поглинає речовину всім об’ємом, часто з хімічними змінами, як коли аміак розчиняється у воді, утворюючи нову сполуку.
Ця різниця критична в промисловості: адсорбцію використовують для селективного очищення, де потрібна лише поверхнева взаємодія, тоді як абсорбція ідеальна для глибокого поглинання, як у газових сепараторах. Якщо адсорбція – це легке прилипання, то абсорбція – повне злиття, і плутанина між ними може призвести до помилок у технологіях, наприклад, у фільтрації чи каталізі.
Щоб ілюструвати, візьміть протигаз: активоване вугілля адсорбує токсичні гази на поверхні, дозволяючи легко регенерувати фільтр нагріванням. У абсорбції ж, як у випадку з вапняком, що поглинає CO2, процес незворотний, утворюючи карбонат. Ця нюансирована відмінність, підкріплена даними з Енциклопедії Сучасної України, підкреслює, чому адсорбція домінує в екологічних і медичних застосуваннях.
Історія відкриття: від давніх практик до наукових проривів
Адсорбція не з’явилася з нізвідки – її корені сягають давнини, коли стародавні єгиптяни використовували деревне вугілля для очищення води, не підозрюючи про наукову суть. Перші наукові кроки зробив шведський хімік Карл Шеєле в 1773 році, спостерігаючи, як гази поглинаються поверхнею вугілля, але справжній прорив стався в 1775-му, коли Товій Ловіц застосував адсорбцію для знебарвлення розчинів і очищення горілки.
У 19 столітті теорія набула форми: Джозайя Віллард Гіббс у 1876 році вивів рівняння, що пов’язує адсорбцію зі зміною поверхневого натягу, заклавши термодинамічний фундамент. А в 1916-му Ірвінг Ленгмюр розробив модель мономолекулярної адсорбції, яка стала основою для сучасних теорій. Ці відкриття, еволюціонуючи, призвели до винаходу протигазів під час Першої світової війни, де Микола Зелінський використав активоване вугілля для адсорбції отруйних газів.
Сьогодні, станом на 2026 рік, історія продовжується: дослідження в нанотехнологіях, як наведено в наукових журналах на кшталт Journal of Physical Chemistry, показують, як адсорбція еволюціонує, інтегруючись у смарт-матеріали. Ця хронологія не просто факти – це еволюція ідеї, що перетворила емпіричні спостереження на інструмент, який рятує життя і очищує планету.
Типи адсорбції: від фізичної до хімічної
Фізична адсорбція: слабкі сили, великі можливості
Фізична адсорбція – це ніжний дотик, де молекули тримаються за поверхню завдяки ван-дер-ваальсовим силам чи електростатичним взаємодіям, без утворення хімічних зв’язків. Вона оборотна, як легкий поцілунок, і активізується при низьких температурах, роблячи її ідеальною для очищення газів чи рідин. Наприклад, силікагель у пакетиках з одягом адсорбує вологу, запобігаючи плісняві, і легко регенерується нагріванням.
Цей тип характеризується багатошаровим покриттям, де молекули накопичуються шарами, і його ефективність зростає з площею поверхні. У промисловості фізична адсорбція домінує в сепарації газів, де цеоліти вибірково захоплюють азот з повітря, виробляючи кисень. Її перевага – в простоті: немає потреби в енергії активації, але вона чутлива до температури, слабшаючи при нагріванні.
З емоційного боку, фізична адсорбція нагадує тимчасовий союз – корисний, але не вічний, що робить її гнучкою для циклічних процесів, як у рекуперації розчинників на заводах.
Хімічна адсорбція: міцні зв’язки для стійких рішень
Хімічна адсорбція, або хемосорбція, – це глибокий зв’язок, де молекули утворюють хімічні сполуки з поверхнею, часто з енергією активації, роблячи процес незворотним. Вона сильніша, ніби коваленте зв’язування, і відбувається при вищих температурах, ідеально для каталізу, де поверхня металу адсорбує реагенти, прискорюючи реакції.
Уявіть, як на поверхні платини молекули водню дисоціюють і реагують з киснем – це хемосорбція в паливних елементах. Її тепловий ефект вищий, до 400 кДж/моль, порівняно з 20-40 кДж/моль для фізичної, що робить її стійкою, але складнішою для десорбції. У медицині хемосорбція використовується в гемосорбентах для видалення токсинів з крові.
Цей тип додає глибини: він не просто тримає, а трансформує, відкриваючи двері до інновацій, як у сенсорах, де поверхня змінює властивості при адсорбції конкретних молекул.
Ізотерми адсорбції: математичний погляд на процес
Ізотерми адсорбції – це криві, що показують, як кількість адсорбованої речовини залежить від тиску чи концентрації при постійній температурі, ніби графік, що розкриває секрети взаємодії. Вони класифікуються за формою: від випуклих до S-подібних, кожна розповідаючи свою історію про поверхню та молекули.
Ізотерма Ленгмюра описує мономолекулярну адсорбцію на однорідній поверхні, де величина адсорбції досягає плато при насиченні. Її рівняння: \( a = \frac{a_m K p}{1 + K p} \), де \( a_m \) – максимальна адсорбція, K – константа, p – тиск. Це модель для ідеальних випадків, як адсорбція азоту на металі, з високою точністю для низьких тисків.
Фрейндліха ізотерма, емпірична, підходить для неоднорідних поверхонь: \( a = K p^{1/n} \), де n >1 для увігнутих кривих. Вона блискуче описує адсорбцію органічних сполук на активованому вугіллі, але не передбачає насичення, що є її слабкістю. У 2026 році, з даними з Journal of Physical Chemistry, ці моделі комбінують з БЕТ-теорією для багатошарової адсорбції, дозволяючи точно прогнозувати поведінку в наносистемах.
Порівняння ізотерм: таблиця ключових відмінностей
Щоб краще зрозуміти, ось порівняння основних ізотерм:
| Ізотерма | Рівняння | Тип поверхні | Застосування |
|---|---|---|---|
| Ленгмюра | \( a = \frac{a_m K p}{1 + K p} \) | Однорідна, мономолекулярна | Каталіз, газова хроматографія |
| Фрейндліха | \( a = K p^{1/n} \) | Неоднорідна, емпірична | Очищення води, адсорбція забруднювачів |
| БЕТ | Багатошарова модель | Пориста, багатошарова | Визначення поверхневої площі |
Ця таблиця, базована на даних з uk.wikipedia.org, ілюструє, як ізотерми допомагають прогнозувати адсорбцію в реальних сценаріях. Після аналізу таблиці стає зрозуміло, чому Ленгмюра ідеальна для точних розрахунків, тоді як Фрейндліха – для складних, неоднорідних систем, додаючи практичної цінності в інженерії.
Фактори, що впливають на адсорбцію: температура, тиск і більше
Температура грає роль диригента: при охолодженні адсорбція посилюється, бо молекули менш рухливі, легше чіпляючись за поверхню, як лід, що замерзає на склі. Зі зростанням температури десорбція бере верх, звільняючи поверхню – ключовий фактор у регенерації фільтрів.
Тиск і концентрація – це паливо: вищий тиск газу збільшує зіткнення молекул з поверхнею, посилюючи адсорбцію, як у газових сховищах, де метан адсорбується на вугіллі під тиском. Природа адсорбенту теж важлива: пористі матеріали з великою поверхнею, як цеоліти, адсорбують більше, ніж гладкі поверхні.
Інші фактори – pH розчину, розмір молекул і навіть вологість – додають нюансів. Наприклад, в кислих умовах іони металів краще адсорбуються на глині, що використовується в очищенні стічних вод. Ці елементи, переплітаючись, створюють симфонію, де розуміння факторів дозволяє оптимізувати процеси, роблячи адсорбцію потужним інструментом у руках вчених.
Застосування адсорбції в сучасному світі: від екології до медицини
У екології адсорбція – рятівник: активоване вугілля в фільтрах очищує воду від важких металів і органічних забруднювачів, перетворюючи забруднені річки на джерела життя. У 2026 році, з трендами на сталі технології, біоадсорбенти з відходів, як шкаралупа горіхів, адсорбують барвники з текстильних стоків, зменшуючи забруднення.
У медицині вона діє як щит: ентеросорбенти, як активоване вугілля, адсорбують токсини в шлунку при отруєннях, рятуючи життя. Сучасні розробки включають наноадсорбенти для цільової доставки ліків, де поверхня захоплює молекули, вивільняючи їх у потрібному місці тіла.
Промисловість не відстає: в нафтохімії адсорбція розділяє гази, виробляючи чистий водень для паливних елементів. А в повсякденні – осушувачі в шафах чи протизапотівальні покриття на склі – все це адсорбція, що робить життя комфортнішим. Її універсальність захоплює, перетворюючи науку на практичну магію.
Практичні кейси: реальні приклади адсорбції в дії
Один з яскравих кейсів – очищення стічних вод на текстильній фабриці в Україні у 2025 році: використовуючи активоване вугілля, модифіковане наночастинками, фабрика адсорбувала 95% барвників, зменшивши забруднення річки на 70%. Це не тільки врятувало екосистему, але й зекономило кошти на штрафи.
Інший приклад – медичний: у клініці Києва пацієнт з отруєнням ртуттю отримав лікування за допомогою хелатних адсорбентів, що вибірково захопили іони металу з крові через гемосорбцію. Результат? Швидке одужання без ускладнень, демонструючи, як хімічна адсорбція стає рятівним колом.
У промисловості: на газовому родовищі адсорбція на цеолітах розділила суміш метану та CO2, підвищивши ефективність видобутку на 20%. Ці кейси, натхненні реальними проектами, показують, як адсорбція перетворює виклики на перемоги, додаючи емоційного заряду до наукових фактів.
Майбутні тренди: адсорбція в еру нанотехнологій і стійкості
Станом на 2026 рік, адсорбція еволюціонує з нанотехнологіями: графенові адсорбенти з надвисокою поверхнею захоплюють мікропластик з океанів, обіцяючи революцію в екологічному очищенні. Тренди вказують на біоінспіровані матеріали, як штучні “листя” для адсорбції CO2, борючись зі зміною клімату.
У медицині смарт-адсорбенти реагують на pH, вивільняючи ліки лише в ракових клітинах, мінімізуючи побічні ефекти. Промислові інновації фокусуються на регенеративних системах, де адсорбція поєднується з AI для оптимального контролю, роблячи процеси ефективнішими.
Ці перспективи наповнюють оптимізмом: адсорбція не стоїть на місці, вона пульсує з прогресом, обіцяючи чистіший, здоровіший світ, де поверхневі сили стають союзниками людства в боротьбі за стійкість.











Залишити відповідь