Атоми, ці крихітні цеглинки Всесвіту, ховають у собі цілий світ енергії та руху, де електрони танцюють навколо ядра, наче бджоли навколо вулика. Уявіть, як у серці кожного елемента, від простого водню до складного урану, відбувається безперервна симфонія взаємодій, що визначає все – від кольору неба до міцності металу. Ця електронна будова не просто абстрактна теорія; вона пояснює, чому речовини реагують, світяться чи залишаються інертними, і саме з неї починається розуміння хімії та фізики.
Коли ми заглиблюємося в цю тему, стає зрозуміло, наскільки еволюціонувала наука: від перших ідей Демокріта про неподільні частинки до сучасних квантових моделей. Електрони не просто кружляють по орбітах, як планети навколо Сонця; вони існують у хмарах ймовірностей, де точне положення – це гра в хованки з природою. Для початківців це може здатися магією, але крок за кроком розберемо, як усе влаштовано, додаючи деталі для тих, хто вже знайомий з основами.
Історичний шлях до розуміння електронної структури
Подорож у світ електронної будови атома починається з давніх мислителів, які інтуїтивно відчували, що матерія складається з дрібних частинок. У 19 столітті Джон Дальтон оживив ідею атома як неподільної кульки, але справжній прорив стався з відкриттям електрона Джозефом Джоном Томсоном у 1897 році – це був момент, коли атом перестав бути монолітом. Томсон уявив атом як пиріг з родзинками, де негативно заряджені електрони вкраплені в позитивну масу, але ця модель швидко поступилася місцем іншим.
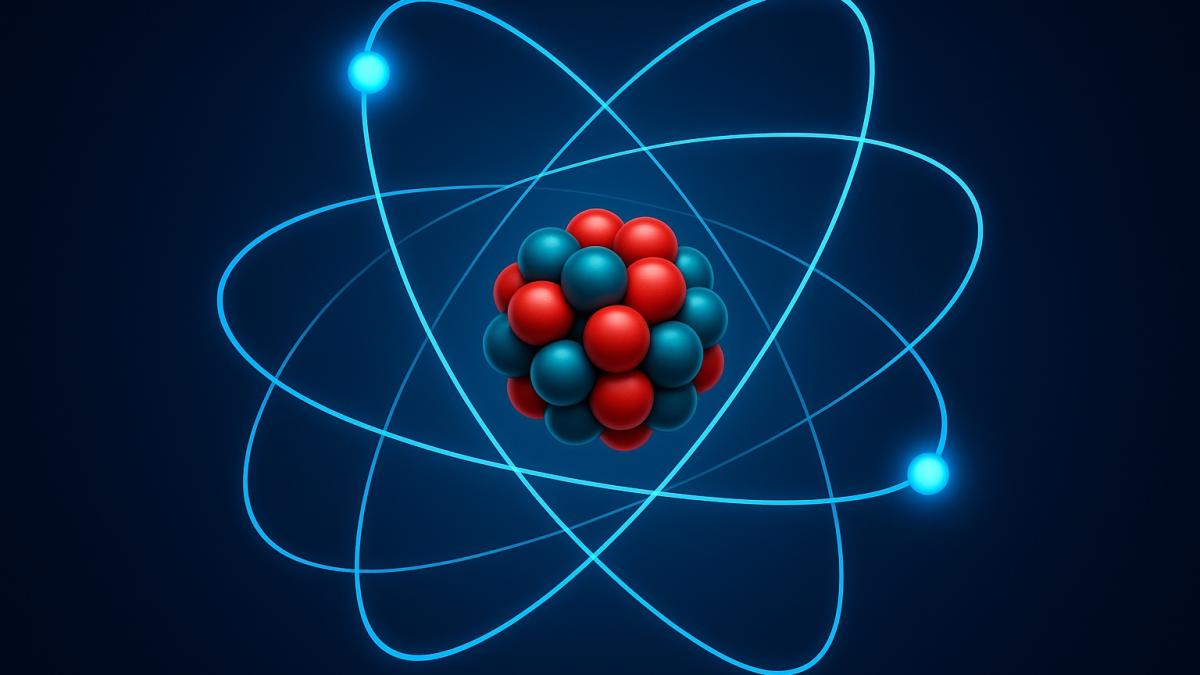
Ернест Резерфорд у 1911 році, експериментуючи з альфа-частинками, виявив, що атом має щільне ядро, оточене порожнечею з електронами – наче мініатюрна Сонячна система. Ця планетарна модель надихала, але мала проблему: чому електрони не падають на ядро через електромагнітне випромінювання? Тут на сцену вийшов Нільс Бор у 1913 році, запропонувавши, що електрони рухаються по фіксованих орбітах з певними енергетичними рівнями, стрибаючи між ними, як жаби по лататтю, випромінюючи чи поглинаючи енергію у вигляді квантів.
Борівська модель блискуче пояснила спектр водню, але для складніших атомів вона тріскалася по швах. Просунуті читачі знають, що справжня революція прийшла з квантовою механікою в 1920-х: Ервін Шредінгер і Вернер Гейзенберг показали, що електрони – це хвилі ймовірності, а не точні частинки. Їхні рівняння, як-от хвильова функція Шредінгера, описують електронну хмару, де ймовірність знайти електрон варіюється, наче густина туману в лісі.
Основні компоненти атома та роль електронів
У центрі кожного атома – ядро, щільний клубок протонів і нейтронів, що несе позитивний заряд і майже всю масу. Навколо нього кружляють електрони, легкі й негативно заряджені, визначаючи хімічні властивості елемента. Кількість електронів дорівнює кількості протонів у нейтральному атомі, і саме їхня конфігурація – електронна будова – диктує, як атом взаємодіє з іншими.
Для початківців уявіть електронну оболонку як багатоповерховий будинок: кожен поверх (енергетичний рівень) може вмістити певну кількість мешканців (електронів). Перший рівень, найближчий до ядра, приймає до 2 електронів, другий – до 8, і так далі, за формулою 2n², де n – номер рівня. Але це спрощення; реальність складніша, з підрівнями та орбіталями, де електрони групуються в s, p, d, f орбіталі, кожна з унікальною формою – від сферичної s до гантелеподібної p.
Порівняймо з реальним прикладом: у атомі вуглецю (атомний номер 6) шість електронів розподіляються як 1s² 2s² 2p². Це означає два на першій s-орбіталі, два на другій s і два на p. Така конфігурація робить вуглець універсальним будівельником органічних молекул, дозволяючи чотири ковалентні зв’язки. Просунуті користувачі оцінять, як правило Гунда максимізує неспарені електрони для стабільності, додаючи шар стратегії в цю квантову гру.
Квантові числа: ключ до електронної адреси
Кожний електрон в атомі має унікальний “паспорт” – набір квантових чисел, що визначають його стан. Головне квантове число n вказує на енергетичний рівень, подібно до номера поверху. Азимутальне l визначає форму орбіталі (0 для s, 1 для p тощо), магнітне m_l – орієнтацію в просторі, а спінове m_s – напрямок спіна, +1/2 або -1/2, наче стрілка компаса.
Ці числа не випадкові; вони випливають з розв’язків рівняння Шредінгера. Наприклад, для n=3, l може бути 0,1,2, створюючи 3s, 3p, 3d підрівні. Принцип Паулі забороняє двом електронам мати однакові набори чисел, забезпечуючи унікальність, як відбитки пальців. Це пояснює, чому оболонки заповнюються послідовно, формуючи періодичну таблицю – геніальну карту електронних конфігурацій.
Уявіть азот (атомний номер 7): 1s² 2s² 2p³. Три неспарені електрони на p-орбіталях роблять його реактивним, ідеальним для утворення аміаку. Для просунутих: гібридизація, як sp³ у метані, змішує орбіталі, створюючи нові форми для оптимальних зв’язків, демонструючи гнучкість електронної структури.
Електронні конфігурації та періодична таблиця
Періодична таблиця Менделєєва – це не просто список елементів; це візуалізація електронної будови, де періоди відповідають енергетичним рівням, а групи – валентним електронам. Елементи в одній групі мають подібні конфігурації зовнішньої оболонки, отже, схожі властивості: лужні метали з ns¹ легко віддають електрон, галогени з ns²np⁵ хапають його.
Заповнення оболонок йде за правилом Кляйковського (n+l), де нижче n+l – пріоритетніше. Тому 4s заповнюється перед 3d, пояснюючи аномалії як у хромі ( [Ar] 4s¹3d⁵ для стабільності напівзаповненої d-орбіталі). Це робить таблицю динамічною: перехідні метали з d-електронами показують змінну валентність, наче хамелеони в хімії.
Для початківців візьміть натрій: [Ne] 3s¹. Один валентний електрон робить його м’яким, реактивним металом. Просунуті читачі зацікавляться лантаноїдами, де f-орбіталі заповнюються, впливаючи на магнітні властивості, як у неодимових магнітах для сучасних технологій.
Вплив на хімічні властивості та застосування
Електронна будова визначає все: іонний радіус, електронегативність, типи зв’язків. У благородних газів заповнені оболонки роблять їх інертними, ідеальними для ламп чи лазерів. У напівпровідниках, як кремній з [Ne] 3s²3p², домішки змінюють конфігурацію, створюючи транзистори – основу комп’ютерів.
Сучасні приклади вражають: у квантових комп’ютерах кубіти базуються на спінах електронів, експлуатуючи квантову суперпозицію. Або в спектроскопії: лінії випромінювання водню, передбачені Бором, тепер використовуються в астрономії для вивчення далеких галактик.
Цікаві факти про електронну будову атома
- 🔬 Електрони в атомі рухаються зі швидкістю до 2,2 мільйона метрів на секунду, але через принцип невизначеності Гейзенберга ми ніколи не знаємо точно, де вони – це квантова таємниця, що робить реальність розмитою на мікроскопічному рівні.
- 🌟 У зірках, як наше Сонце, електронні переходи в атомах водню створюють світло, яке ми бачимо; без цього не було б сонячних днів чи фотоелектричних панелей.
- 💡 Атомний годинник, найточніший у світі, базується на вібраціях електронів у цезії – вони відміряють час з похибкою 1 секунди на 300 мільйонів років, завдяки стабільній електронній структурі.
- 🧲 Магнітні властивості Землі частково завдячують d-електронам у залізі ядра, що генерують поле, захищаючи нас від сонячного вітру.
- ⚛️ Найбільший атом – цезій з радіусом 260 пікометрів, де зовнішні електрони ледь тримаються, роблячи його надзвичайно реактивним.
Ці факти не просто курйози; вони ілюструють, як електронна будова пронизує повсякденне життя, від гаджетів до космосу. Продовжуючи, розглянемо, як квантова механіка додає шар невизначеності.
Квантова механіка в електронній структурі
Квантова механіка перетворює електронну будову на ймовірнісну модель: хвильова функція ψ описує амплітуду, а |ψ|² – ймовірність знайти електрон. Орбіталі – це регіони з високою ймовірністю, не траєкторії. Для водню 1s-орбіталь – сфера, де електрон “розмазаний” навколо ядра.
У багатоелектронних атомах взаємодії ускладнюють розрахунки; наближення Хартрi-Фока допомагає, але для точності потрібні суперкомп’ютери. Просунуті читачі знають про релятивістські ефекти в важких елементах, де електрони біля ядра досягають швидкостей, близьких до світла, змінюючи конфігурації, як у золота, роблячи його жовтим.
Експерименти підтверджують: тунельний ефект дозволяє електронам “просочуватися” через бар’єри, ключовий для ядерного синтезу в зірках. Або ефект Зеемана: магнітне поле розщеплює рівні, розкриваючи спін-орбітальну взаємодію.
Порівняння моделей будови атома
Щоб краще зрозуміти еволюцію ідей, ось таблиця з ключовими моделями.
| Модель | Автор і рік | Ключові особливості | Переваги | Недоліки |
|---|---|---|---|---|
| Планетарна | Резерфорд, 1911 | Ядро в центрі, електрони на орбітах | Пояснює розсіювання альфа-частинок | Не враховує стабільність орбіт |
| Борівська | Бор, 1913 | Квантовані орбіти, стрибки електронів | Пояснює спектр водню | Не працює для багатоелектронних атомів |
| Квантова | Шредінгер/Гейзенберг, 1920-ті | Хвильові функції, орбіталі | Універсальна, точна для всіх атомів | Складна для інтуїтивного розуміння |
Ця таблиця базується на даних з наукових джерел, таких як журнал Physical Review та сайт Britannica. Вона показує, як кожна модель будувалася на попередній, додаючи глибини.
Розглядаючи ці аспекти, стає ясно, наскільки електронна будова атома – це не статична картина, а динамічний процес, що еволюціонує з новими відкриттями. У лабораторіях по всьому світу вчені продовжують розкривати її таємниці, від суперсиметрії до квантових точок у нанотехнологіях, обіцяючи революції в енергетиці та медицині.
А для тих, хто тільки починає, пам’ятайте: кожен атом – це мікрокосмос, де правила квантового світу диктують макроскопічну реальність. Занурюючись глибше, ви відкриваєте двері до нескінченних можливостей, де наука межує з поезією руху частинок.











Залишити відповідь