Хімічна таблиця елементів стоїть наче величний маяк у океані науки, освітлюючи шлях від перших атомних загадок до космічних таємниць. Вона не просто список символів і чисел – це жива мапа, де кожен елемент розповідає історію про народження зірок, еволюцію матерії та людські відкриття. Коли Дмитро Менделєєв у 1869 році вперше розклав елементи за зростанням атомної маси, він відкрив двері до розуміння, як природа організовує свій будівельний матеріал. Ця таблиця еволюціонувала, насичуючись новими відкриттями, і сьогодні, у 2025 році, налічує 118 елементів, з яких останні були синтезовані в лабораторіях.
Уявіть, як елементи, розкидані по таблиці, ніби гравці на шаховій дошці, взаємодіють у реальному світі – від кисню, що дає життя нашим легеням, до урану, що живить ядерні реактори. Ця система не статична; вона пульсує з відкриттями, як серцебиття науки. А тепер зануримося глибше в її витоки, де геній Менделєєва перетворив хаос на гармонію.
Історія відкриття періодичної системи
Дмитро Іванович Менделєєв, російський хімік з сибірським корінням, не просто склав таблицю – він передбачив існування невідомих елементів, ніби провидець, що заглядає в майбутнє. У 1869 році, працюючи над підручником хімії, він помітив, що властивості елементів повторюються періодично при сортуванні за атомною масою. Наприклад, літій, натрій і калій виявляли схожі риси, наче брати з однієї родини. Менделєєв залишив прогалини для “майбутніх” елементів, назвавши їх ека-алюмінієм і ека-кремнієм, які згодом виявилися галієм і германієм.
Але Менделєєв не був самотнім у пошуках. Ще в 1864 році Джон Ньюлендс запропонував “закон октав”, де елементи повторювалися кожні вісім, як ноти в музиці, але його ідея зустріла глузування. Лотар Мейер незалежно працював над подібною системою, фокусуючись на фізичних властивостях. Лише в 1913 році Генрі Мозлі вдосконалив таблицю, сортуючи за атомним номером – зарядом ядра, що розв’язало суперечки про позиції деяких елементів, як кобальт і нікель. Сьогодні, за даними Міжнародного союзу чистої та прикладної хімії (IUPAC), таблиця оновлюється з новими синтетичними елементами, такими як оганесон, названий на честь Юрія Оганесяна в 2016 році.
Ця еволюція нагадує будівництво собору: покоління вчених додавали цеглинки, від середньовічних алхіміків, що мріяли про філософський камінь, до сучасних прискорювачів частинок. У 2025 році таблиця слугує основою для квантової хімії, де комп’ютерні моделі прогнозують властивості гіпотетичних елементів за межами 118-го.
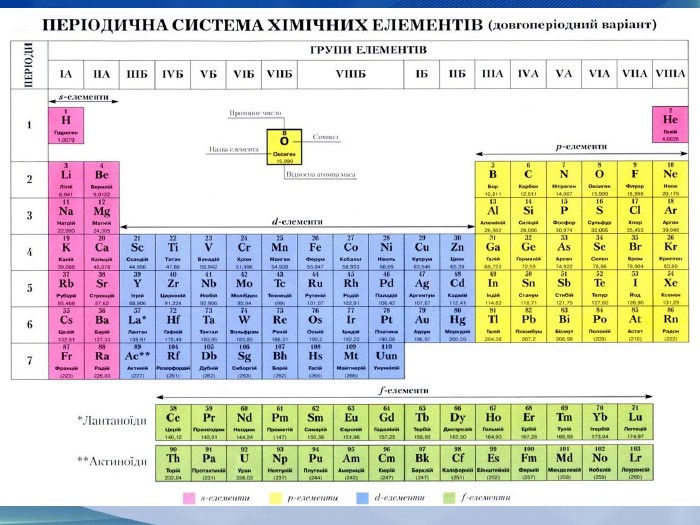
Структура періодичної таблиці: періоди, групи та блоки
Таблиця поділена на періоди – горизонтальні рядки, де кожен наступний період додає шар електронів, ніби шари цибулі, що обгортають ядро. Перший період простий, з воднем і гелієм, тоді як сьомий, з францієм і радоном, стає нестабільним через радіоактивність. Групи – вертикальні стовпці – об’єднують елементи з подібними властивостями: лужні метали в першій групі вибухають у воді, а галогени в сімнадцятій – агресивні окислювачі.
Блоки додають ще один шар: s-блок для елементів з валентними електронами на s-орбіталі, p-блок для неметалів і металів з p-електронами, d-блок для перехідних металів, як залізо, що дає міцність сталям, і f-блок для лантаноїдів та актиноїдів, рідкісноземельних елементів, критичних для електроніки. Кожен елемент позначається символом, атомним номером і масою – наприклад, вуглець (C, 6, 12.011), основа життя, з його алотропами від алмазу до графіту.
Ця структура не випадкова; вона відображає квантову механіку, де орбіталі заповнюються за правилом Гунда і принципом Паулі. Уявіть таблицю як симфонію, де періоди – це такти, а групи – інструменти, що грають у гармонії. Для початківців це карта скарбів, а для просунутих – інструмент для прогнозування реакцій, як у синтезі нових матеріалів.
Як читати таблицю: ключові позначення
Кожен квадрат таблиці – це вікно в світ елемента. Атомний номер вказує кількість протонів, визначаючи ідентичність, тоді як атомна маса враховує ізотопи, як у хлору з 35Cl і 37Cl. Електронегативність, радіус атома і потенціал іонізації додають деталі: фтор, з найвищою електронегативністю 4.0, хапає електрони, наче голодний вовк.
Колірні кодування в сучасних версіях виділяють метали (сині), неметали (червоні) і напівметали (зелені), полегшуючи навігацію. Для просунутих користувачів таблиця розкриває тренди: атомний радіус зменшується вправо по періоду через посилення ядерного притягання, а вниз по групі зростає, як дерево, що тягнеться до сонця.
Властивості елементів і їх періодична залежність
Періодичний закон Менделєєва стверджує, що властивості елементів змінюються періодично з ростом атомного номеру. Металевість посилюється вниз і вліво: цезій, м’який метал, реагує з повітрям, тоді як фтор – газ, що роз’їдає скло. Іонізаційна енергія, енергія для видалення електрона, падає вниз по групі, роблячи калій реактивнішим за натрій.
Приклади оживають у реакціях: лужноземельні метали, як магній, горять яскраво, даючи світло феєрверкам, а благородні гази, як неон, світяться в лампах без реакцій. Для глибшого розуміння розгляньмо перехідні метали: хром утворює барвисті сполуки, від жовтого хромату до зеленого оксиду, використовувані в фарбах і хімії. Ці властивості пояснюються електронними конфігураціями, де d-орбіталі створюють магнітні ефекти в залізі чи каталіз у платині.
У 2025 році вчені досліджують надважкі елементи, як ліверморій (116), синтезований у прискорювачах, з потенціалом для “острова стабільності” біля 120-го елемента, де ядра можуть жити довше, ніж миті. Це не просто теорія; експерименти в Дубні та Дармштадті підтверджують прогнози, відкриваючи двері до нових матеріалів.
Використання таблиці в науці та повсякденному житті
Таблиця – інструмент для хіміків, що прогнозує реакції, як у синтезі ліків: аспірин базується на вуглеці та кисні. У матеріалознавстві кремній з p-блоку формує напівпровідники для чіпів, тоді як рідкісноземельні елементи, як неодим, живлять магніти в електромобілях. У 2025 році, з переходом на зелену енергію, літій і кобальт з таблиці стають ключовими для батарей, з глобальним видобутком літію сягаючим 180 тисяч тонн щорічно.
У біології елементи грають ролі: залізо в гемоглобіні переносить кисень, кальцій будує кістки. Навіть у космосі: гелій, утворений у Великому Вибуху, охолоджує телескопи, як “Джеймс Вебб”. Для початківців таблиця пояснює, чому сіль (NaCl) розчиняється у воді, а для просунутих – моделює квантові обчислення для нових сплавів.
Практичні приклади множаться: у фармацевтиці йод запобігає щитовидним хворобам, а в екології ртуть, токсичний метал, вимагає обережного поводження. Таблиця надихає інновації, як у нанотехнологіях, де золото стає каталізатором для чистих реакцій.
Цікаві факти про хімічну таблицю елементів
Ось кілька захопливих деталей, що роблять таблицю живою легендою науки.
- 🔭 Менделєєв передбачив властивості германію так точно, що коли його відкрили в 1886 році, реальні дані збіглися з прогнозами, наче з наукової фантастики – щільність 5.35 г/см³ проти передбачених 5.5.
- 🌟 Елементи важчі за залізо утворюються в наднових зірках, тож золото в ваших прикрасах – це зоряний пил від вибухів мільярди років тому, як підтверджують астрономічні спостереження.
- 🧪 Технецій, елемент 43, – перший синтетичний, створений у 1937 році, і він радіоактивний, використовуваний у медичній діагностиці для сканування органів.
- 💥 У 2025 році вчені продовжують полювання за елементом 119, потенційно в новому періоді, що може перевернути розуміння стабільності ядер, за даними лабораторій як CERN.
- 🎨 Назви елементів часто поетичні: кюрій на честь Марії Кюрі, айнштейній – Альберта Ейнштейна, роблячи таблицю пантеоном геніїв.
Ці факти підкреслюють, як таблиця переплітає історію, космос і людську винахідливість, роблячи хімію не сухою наукою, а пригодою.
Сучасні виклики та майбутнє таблиці
У 2025 році таблиця стикається з викликами: синтез надважких елементів вимагає гігантських прискорювачів, як у Японії чи Німеччині, де витрати сягають мільйонів. Екологічні аспекти турбують: видобуток рідкісних елементів, як літій, призводить до забруднення в Болівії чи Австралії. Вчені пропонують рециклінг, перетворюючи відходи на ресурси.
Майбутнє обіцяє розширення: теорії передбачають “суперактиноїди” за 120-м елементом, з властивостями, що імітують легші аналоги. У освіті таблиця стає інтерактивною – додатки дозволяють моделювати реакції на смартфонах, роблячи навчання динамічним. Для просунутих це інструмент для AI-моделювання, як у відкритті нових каталізаторів для водневої енергії.
Таблиця еволюціонує, ніби жива істота, адаптуючись до нових відкриттів. Вона нагадує, що наука – це не кінець, а безкінечний шлях, де кожен елемент додає штрих до картини Всесвіту.
Важливо пам’ятати: періодичний закон не просто правило, а фундамент, на якому стоїть уся сучасна хімія, від ліків до космічних польотів.
| Група | Приклади елементів | Ключові властивості | Застосування |
|---|---|---|---|
| Лужні метали | Літій, Натрій | Висока реактивність з водою | Батареї, сіль |
| Галогени | Фтор, Хлор | Сильні окислювачі | Дезінфекція, пластики |
| Перехідні метали | Залізо, Золото | Каталітичні властивості | Сталь, ювелірка |
| Благородні гази | Гелій, Неон | Інертність | Повітряні кулі, освітлення |
Ця таблиця ілюструє базові групи, базуючись на даних з Вікіпедії та сайту IUPAC.org. Вона спрощує порівняння, показуючи, як властивості диктують використання.
Уявіть, як таблиця впливає на повсякденність: фосфор у сірниках спалахує від тертя, а кремній у склі захищає від стихій. Для початківців це вступ до хімії, а для просунутих – ключ до інновацій, як у квантових комп’ютерах на основі кремнію з домішками. Помилки в розумінні, як плутанина атомної маси з номером, легко виправити, вивчаючи тренди.
Наостанок, таблиця – це не музейний експонат, а динамічний інструмент, що надихає нові покоління. Вона шепоче історії про атоми, що танцюють у реакціях, і обіцяє відкриття, що змінять світ.












Залишити відповідь