Ліс шепоче таємниці, коли листя на деревах перетворює сонячне світло на енергію, а десь у ґрунті невидимі процеси розкладають опале гілки, повертаючи поживні речовини назад у коло життя. Ці хімічні явища в природі – не просто абстрактні реакції, а жива симфонія перетворень, де атоми танцюють у ритмі всесвіту, створюючи все, що ми бачимо навколо. Вони формують основу існування, від мікроскопічних взаємодій у клітинах до грандіозних подій, як виверження вулканів, де лава реве, випускаючи гази, що змінюють атмосферу.
Кожна така реакція – це історія про баланс і хаос, де речовини розпадаються і з’єднуються, ніби актори в нескінченній драмі. Подумайте про те, як звичайний дощ стає частиною глобального циклу, розчиняючи мінерали в ґрунті та переносячи їх до океанів. Ці процеси не стоять осторонь від нас; вони пульсують у кожному подиху, у їжі, яку ми споживаємо, і навіть у кольорах заходу сонця, спричинених розсіюванням світла через хімічні сполуки в повітрі.
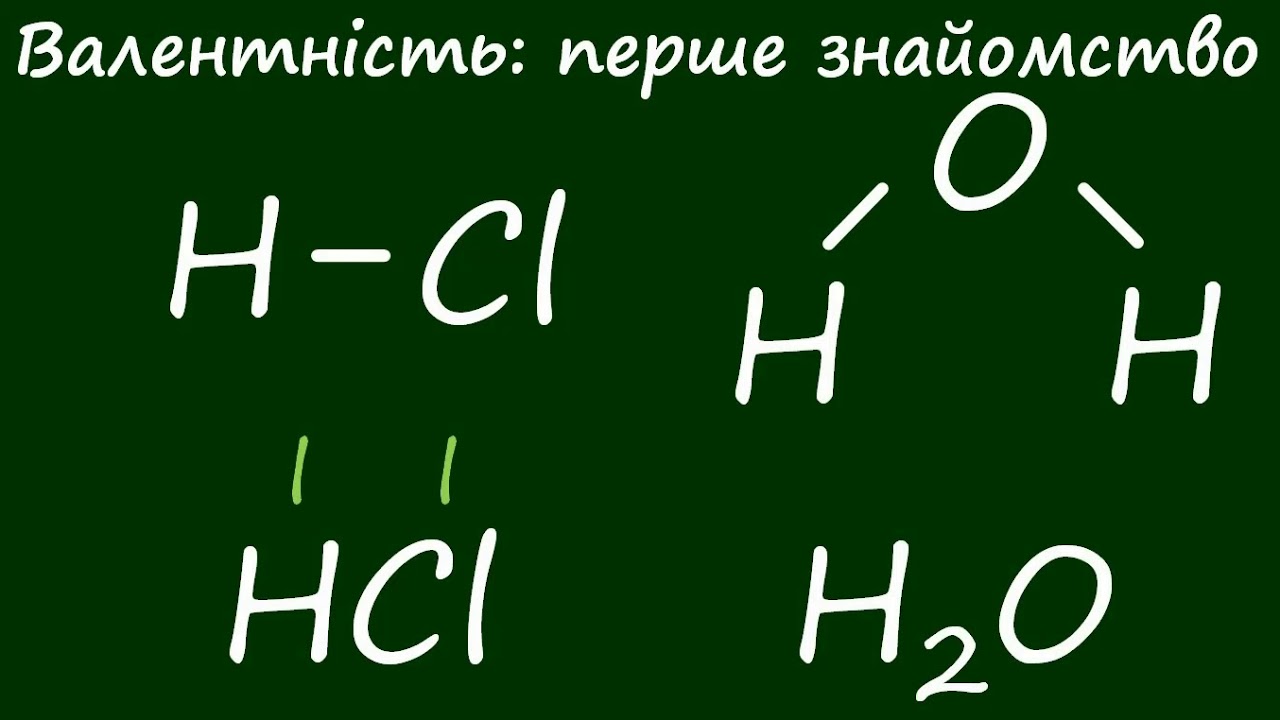
Що таке хімічні явища в природі та як вони відрізняються від фізичних
Хімічні явища в природі – це перетворення, коли речовини змінюють свою сутність, утворюючи нові сполуки з відмінними властивостями. На відміну від фізичних процесів, де нічого не створюється заново – як танення льоду, що просто переходить з твердого стану в рідкий, – хімічні реакції ламають і будують молекулярні зв’язки. Наприклад, коли залізо іржавіє під впливом кисню і вологи, воно не просто змінює форму, а перетворюється на оксид заліза, втрачаючи міцність і набуваючи рудого відтінку, ніби природа малює свої картини корозією.
Ці явища супроводжуються виділенням або поглинанням енергії, часто у формі тепла, світла чи газу, роблячи їх помітними і драматичними. Уявіть вогонь, що пожирає суху траву: це не просто полум’я, а ланцюг реакцій, де вуглець з’єднується з киснем, вивільняючи енергію, яка зігріває ніч і освітлює шлях. Фізичні ж процеси, як випаровування води, лишають речовину незмінною за складом, просто переміщуючи її в інший стан, наче гра в хованки з молекулами.
Розрізняючи їх, ми розуміємо, чому деякі зміни незворотні: хімічні реакції часто потребують каталізаторів, як ферменти в живих організмах, що прискорюють процеси без власної втрати. У природі це відбувається постійно, від клітинного рівня до глобальних циклів, формуючи екосистеми, де кожна реакція – ланка в ланцюгу виживання.
Визначення та ключові характеристики
Хімічні явища характеризуються зміною хімічного складу, що призводить до утворення нових речовин. Вони вимагають активаційної енергії – того першого поштовху, як іскра для пожежі, – і часто залежать від умов, таких як температура чи присутність каталізаторів. У природі ці реакції бувають екзотермічними, виділяючи тепло, або ендотермічними, поглинаючи його, ніби рослини, що крадуть сонячну енергію для зростання.
Одна з ключових рис – утворення продуктів з новими властивостями: вода і вуглекислий газ з горіння деревини не схожі на вихідні матеріали. Це відрізняє їх від фізичних явищ, де молекули лишаються тими ж, просто перерозподіляються. Природа майстерно балансує ці процеси, забезпечуючи кругообіг речовин, від азотного циклу в ґрунті до вуглецевого в атмосфері.
Найпоширеніші приклади хімічних явищ у природі
Фотосинтез – це диво, де зелені листки перетворюють вуглекислий газ і воду на глюкозу та кисень під сонячним промінням, ніби рослини – маленькі фабрики, що годують планету. Ця реакція не просто годує травоїдних, а й наповнює атмосферу киснем, роблячи життя можливим для нас усіх. Без неї Земля була б пустелею, позбавленою того свіжого подиху, який ми сприймаємо як належне.
Інший приклад – гниття органічних решток, де бактерії розкладають мертву матерію, вивільняючи поживні речовини назад у ґрунт. Це процес ферментації та окислення, що пахне землею після дощу, перетворюючи сміття на родючий гумус. А горіння, як у лісових пожежах, вивільняє енергію, оновлюючи екосистеми, хоч і руйнуючи все на шляху, ніби природа очищає себе вогнем.
Іржавіння металів у вологому середовищі – ще один тихий процес, де кисень реагує з залізом, утворюючи оксид, що кришить мости і машини з часом. У океанах хімічні реакції розчиняють вапняк, формуючи печери, а в атмосфері озон захищає нас від ультрафіолету, розкладаючись і реформуючись у безперервному танці молекул.
Фотосинтез: основа життя на Землі
У серці кожної зеленої клітини хлоропласти проводять фотосинтез, використовуючи хлорофіл для захоплення світла. Реакція виглядає так: 6CO₂ + 6H₂O → C₆H₁₂O₆ + 6O₂, але за цим рівнянням ховається складний ланцюг, де електрони стрибають, ніби в космічному балеті. Рослини не просто ростуть; вони перетворюють сонячну енергію на хімічну, годуючи харчовий ланцюг і регулюючи клімат.
Цей процес еволюціонував мільярди років тому, змінивши атмосферу з вуглекислого газу на кисневу, що дозволило з’явитися складним формам життя. Сьогодні фотосинтез відповідає за близько 100 мільярдів тонн органічної речовини щорічно, за даними наукових оцінок, роблячи його найпотужнішим хімічним явищем у природі.
Горіння та окислення: енергія вогню
Горіння – це швидке окислення, де паливо з’єднується з киснем, вивільняючи тепло і світло. У лісах воно оновлює ґрунт, стимулюючи ріст нових рослин, але в надмірній мірі спричиняє пожежі, що змінюють ландшафти. Окислення ж, повільніше, як у іржавінні, роз’їдає метали, але також живить наше дихання, де кисень перетворює глюкозу на енергію в клітинах.
Ці реакції – основа метаболізму, де мітохондрії в наших тілах проводять клітинне дихання, протилежне фотосинтезу. Без них життя згасло б, як полум’я без кисню.
Механізми хімічних реакцій у природному середовищі
У природі реакції часто каталізуються ферментами чи мінералами, прискорюючи процеси в мільйони разів. Наприклад, у ґрунті бактерії фіксують азот, перетворюючи його на нітрати для рослин, – це складний цикл, де молекули азоту розщеплюються і з’єднуються з воднем. Температура впливає на швидкість: тепліше середовище прискорює реакції, як у тропічних лісах, де розкладання відбувається швидше.
Вода як розчинник грає ключову роль, полегшуючи взаємодію іонів, ніби універсальний посередник. У вулканах високі температури запускають реакції, вивільняючи сірку та вуглекислий газ, що впливають на клімат. Ці механізми еволюціонували, адаптуючись до умов, роблячи природу гігантською лабораторією.
Роль каталізаторів і умов середовища
Каталізатори, як ферменти в організмах, знижують активаційну енергію, дозволяючи реакціям йти при кімнатній температурі. У океанах мінерали каталізують гідроліз, розкладаючи органічні сполуки. pH середовища впливає: кислі дощі прискорюють вивітрювання скель, розчиняючи карбонати.
Світло, як у фотосинтезі, активує реакції, а тиск у глибинах океану змінює динаміку, створюючи унікальні хімічні зони навколо гідротермальних джерел.
Вплив хімічних явищ на екосистеми та людину
Ці явища формують екосистеми, регулюючи кругообіг елементів: вуглець циркулює через фотосинтез і дихання, підтримуючи баланс. Для людини вони – джерело ресурсів, від добрив з азотного циклу до ліків з рослинних реакцій. Але дисбаланс, як забруднення, посилює кислотні дощі, руйнуючи ліси.
У медицині розуміння цих процесів допомагає боротися з хворобами, імітуючи природні реакції. Кліматичні зміни посилюють деякі явища, як океанське закислення, що загрожує кораловим рифам, ніби природа сигналізує про небезпеку.
Людство вчиться від природи, розробляючи біомімікрію – технології, натхненні цими реакціями, як сонячні панелі, що імітують фотосинтез.
Екологічні наслідки та глобальні цикли
Глобальні цикли, як вуглецевий, залежать від хімічних реакцій: океани поглинають CO₂, утворюючи карбонати, але надмірне накопичення призводить до потепління. Азотний цикл годує рослини, але надлишок від добрив викликає евтрофікацію водойм.
Ці процеси впливають на біорізноманіття, де порушення, як вимирання видів, руйнує ланцюги реакцій.
Цікаві факти про хімічні явища в природі
- 🌿 Фотосинтез не тільки виробляє кисень, але й відповідає за колір листя: хлорофіл маскує інші пігменти, які виявляються восени, створюючи барвисте шоу.
- 🔥 Горіння в природі може бути підземним: торф’яні пожежі тліють місяцями, вивільняючи вуглець, накопичений століттями, і змінюючи ґрунт назавжди.
- ⚗️ У печерах хімічні реакції утворюють сталактити: вода з CO₂ розчиняє вапняк, а потім випаровується, лишаючи кристали, ніби природа будує свої скульптури.
- 🌊 Океанське закислення – реакція CO₂ з водою – робить воду кислішою, розчиняючи панцирі молюсків і загрожуючи харчовим ланцюгам.
- ⚡ Блискавки фіксують азот: енергія розщеплює N₂, утворюючи нітрати, які дощ несе в ґрунт, природно удобрюючи землю.
Ці факти підкреслюють, як хімічні явища переплітаються з повсякденним життям, роблячи світ навколо нас динамічним і непередбачуваним. Вони нагадують, наскільки тендітний баланс, який ми маємо берегти.
Порівняння хімічних явищ у різних середовищах
У лісах домінує розкладання, де грибки і бактерії перетворюють органічні рештки на гумус, збагачуючи ґрунт. В океанах гідроліз і окислення формують коралові рифи, але також викликають цвітіння водоростей від надлишку нітратів. У пустелях вивітрювання скель через реакції з вітром і рідкісними дощами створює унікальні формації, ніби час вирізьблює камінь.
Атмосферні явища, як утворення озону, захищають життя, тоді як у вулканічних зонах реакції вивільняють гази, впливаючи на глобальний клімат. Кожне середовище – унікальна арена для цих перетворень.
| Середовище | Приклад явища | Механізм | Вплив |
|---|---|---|---|
| Ліси | Гниття | Бактеріальне розкладання органічних сполук | Збагачення ґрунту поживними речовинами |
| Океани | Закислення | Реакція CO₂ з водою, утворення вугільної кислоти | Руйнування коралових рифів |
| Пустелі | Вивітрювання | Окислення мінералів під впливом вітру та вологи | Формування ландшафтів |
| Атмосфера | Утворення озону | Фотохімічні реакції з киснем | Захист від UV-променів |
Ця таблиця ілюструє різноманітність, показуючи, як одні й ті ж принципи адаптуються до умов. Дані базуються на загальних наукових знаннях, наприклад, з сайту nauka.ua та журналу Nature.
Сучасні дослідження та майбутні перспективи
Сьогодні вчені вивчають, як кліматичні зміни впливають на ці явища: потепління прискорює розкладання в тундрі, вивільняючи метан – потужний парниковий газ. Нові технології, як нано-каталізатори, натхненні природою, обіцяють ефективніше захоплення CO₂. У 2025 році дослідження показують, що мікропластик втручається в океанські реакції, змінюючи pH і загрожуючи морському життю.
Майбутнє – в біотехнологіях, де ми імітуємо природні процеси для сталого розвитку, як штучний фотосинтез для чистої енергії. Ці відкриття не просто наука; вони – ключ до збереження планети, де хімічні явища продовжують формувати наше існування.
Дослідження з лабораторій, як ті, що проводяться в НАСА, розкривають, як подібні реакції могли зародити життя на Землі мільярди років тому, через комбінації органічних сполук у первинному океані. Це надихає на пошук позаземного життя, де хімічні сигнали можуть вказати на подібні процеси на інших планетах.













Залишити відповідь