Уявіть атом як мініатюрну сонячну систему, де ядро – це яскраве сонце, а електрони кружляють навколо, наче планети. Але що робить кожен атом унікальним? Саме протонне число визначає його ідентичність, ніби паспорт у світі елементів. Це фундаментальна характеристика, яка впливає на все – від хімічних реакцій у вашій кухні до ядерних процесів у зірках. У цій статті ми зануримося в глибини цієї концепції, розкриваючи її роль у хімії та фізиці з прикладами, що оживають перед очима.
Протонне число, або ж Z, – це кількість протонів у ядрі атома. Ця цифра не просто абстрактна: вона диктує, яким елементом є атом. Наприклад, якщо в ядрі шість протонів, перед вами вуглець, той самий, що формує основу життя на Землі. Без точного підрахунку протонів елементи б змішувалися в хаосі, а періодична таблиця Менделєєва втратила б свій геніальний порядок. Саме Z забезпечує стабільність і передбачуваність у світі матерії, роблячи науку не просто теорією, а практичним інструментом.
Визначення протонного числа: основи та нюанси
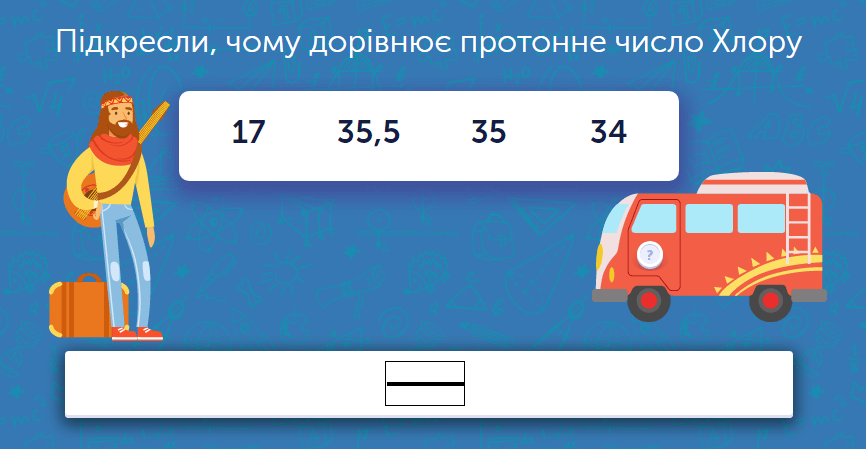
Протонне число – це ціле число, що вказує на кількість позитивно заряджених протонів у атомному ядрі. Воно завжди дорівнює атомному номеру елемента в періодичній системі, і це не випадковість. Протони, ці важкі частинки з масою близько 1,67 × 10^-27 кг, несуть позитивний заряд +1, балансуючи негативні електрони навколо. Якщо Z дорівнює 1, це водень – найпростіший елемент, з одним протоном і одним електроном, що танцюють у космічному дуеті.
Але нюанси ховаються в деталях. У нейтральному атомі кількість електронів збігається з протонним числом, забезпечуючи електричну нейтральність. Однак в іонах ця рівновага порушується: катіон втрачає електрони, аніон набирає. Наприклад, натрію з Z=11 в іоні Na+ бракує одного електрона, що робить його реактивним у солях. Ця концепція стає ключем до розуміння хімічних зв’язків, де елементи з різними Z обмінюються електронами, ніби в грі на виживання.
З історичної перспективи, протонне число набуло форми завдяки Ернесту Резерфорду, який у 1911 році відкрив ядро атома через експерименти з альфа-частинками. Пізніше, у 1913-му, Генрі Мозлі уточнив ідею, показавши, що Z визначає положення елемента в таблиці, а не атомна маса, як вважав Менделєєв. Ці відкриття, перевірені в численних лабораторіях, революціонізували науку, перетворивши хаотичні спостереження на струнку систему.
Як вимірюють протонне число на практиці
Вимірювання Z – це не магія, а точна наука. Спектроскопія рентгенівських променів, розроблена Мозлі, дозволяє визначати Z за частотою випромінювання. Коли атом збуджується, електрони перестрибують рівні, випускаючи фотони з унікальними енергіями, пропорційними Z^2. Сучасні методи, як мас-спектрометрія, розділяють іони за масою та зарядом, даючи точні значення навіть для рідкісних ізотопів.
У лабораторіях фізики частинок, таких як CERN, протонне число вивчають у зіткненнях на високих енергіях. Тут Z допомагає ідентифікувати нові елементи, як оганесон з Z=118, синтезований у 2002 році. Ці експерименти не просто рахують протони – вони розкривають стабільність ядер, де надто велике Z призводить до радіоактивного розпаду, ніби ядро переїдає і вибухає.
Значення протонного числа в хімії: від елементів до реакцій
У хімії протонне число – це компас, що вказує на властивості елемента. Елементи з однаковим Z поводяться подібно, формуючи групи в періодичній таблиці. Взяти кисень з Z=8: він жадібно хапає електрони, створюючи воду чи вуглекислий газ, без яких життя неможливе. Зростання Z збільшує розмір атома, але зменшує електронегативність у групах, роблячи метали м’якшими, а неметали агресивнішими.
Хімічні реакції залежать від Z, бо воно визначає електронну конфігурацію. Наприклад, вуглець (Z=6) утворює чотири ковалентні зв’язки, будуючи ланцюги органічних молекул, від ДНК до пластиків. Без цього числа ми б не мали фармацевтики чи палива – усе тримається на балансі протонів. А в неорганічній хімії Z пояснює, чому золото (Z=79) стійке до корозії, тоді як залізо (Z=26) іржавіє, ніби втомлений воїн.
Практичні приклади оживають у повсякденні. У батарейках літію з Z=3 протони забезпечують легкість і енергію, роблячи смартфони компактними. А в медицині, йод з Z=53 використовують для щитовидки, де його Z визначає поглинання в тканинах. Ці деталі роблять хімію не сухою теорією, а живою силою, що формує наш світ.
Ізотопи та роль протонного числа в них
Ізотопи – це варіації атомів з однаковим Z, але різною кількістю нейтронів. Протонне число тримає їх у одній родині, але масове число A = Z + N змінюється. Вуглець-12 і вуглець-14 мають Z=6, але другий радіоактивний, використовуваний для датування артефактів. Це ніби близнюки з різними характерами: один стабільний, інший непередбачуваний.
У ядерній хімії Z визначає стабільність. Для легких елементів оптимальне співвідношення нейтронів до протонів близько 1:1, але для важких, як уран (Z=92), потрібно більше нейтронів, щоб утримати ядро від розпаду. Якщо Z надто велике, починається альфа-розпад, де ядро викидає гелій (Z=2), намагаючись схуднути. Ці процеси живлять ядерну енергію, де уран-235 розщеплюється, вивільняючи енергію зірок на Землі.
Протонне число в фізиці: від ядер до космосу
У фізиці протонне число – це фундамент ядерних взаємодій. Воно визначає кулонівську силу відштовхування між протонами, яку долає сильна ядерна взаємодія. Без балансу Z ядра б розпадалися миттєво, і Всесвіт був би порожнім. У зірках, як наше Сонце, протони водню (Z=1) зливаються в гелій, вивільняючи енергію, що зігріває планети.
Квантова механіка додає шарму: Z впливає на енергетичні рівні електронів, формуючи спектри, які астрономи читають, ніби книгу. Далекий зірковий газ з Z=26 видає лінії заліза, розповідаючи про еволюцію галактик. А в частинковій фізиці, протони прискорюють у LHC до швидкостей, близьких до світла, щоб вивчити, як Z впливає на кварки всередині.
Сучасні застосування вражають. У медичній фізиці, протонна терапія використовує пучки протонів для точного знищення пухлин, де Z допомагає контролювати глибину проникнення. Це ніби снайперська гвинтівка проти раку, мінімізуючи шкоду здоровим тканинам. А в матеріалознавстві, елементи з високим Z, як свинець (Z=82), блокують радіацію, захищаючи астронавтів у космосі.
Порівняння протонного числа з іншими ядерними характеристиками
Щоб краще зрозуміти Z, порівняймо його з масовим числом A і нейтронним числом N. Ось таблиця для ключових елементів:
| Елемент | Протонне число (Z) | Масове число (A) | Нейтронне число (N) | Властивості |
|---|---|---|---|---|
| Водень-1 | 1 | 1 | 0 | Стабільний, основа зірок |
| Вуглець-12 | 6 | 12 | 6 | Стабільний, основа життя |
| Уран-235 | 92 | 235 | 143 | Радіоактивний, для енергії |
| Оганесон-294 | 118 | 294 | 176 | Синтетичний, нестабільний |
Ця таблиця ілюструє, як Z залишається константою для елемента, тоді як A варіюється. Дані взяті з авторитетних джерел, таких як сайт Міжнародного союзу чистої та прикладної хімії (iupac.org). Вона підкреслює, що для стабільності N повинно зростати з Z, інакше ядро стає нестійким, як переповнена лодка.
Після аналізу таблиці стає ясно, чому Z – це не просто число, а ключ до ядерної архітектури. Воно пояснює, чому легкі елементи домінують у Всесвіті, а важкі – рідкісні, народжені в надрах зірок чи лабораторіях.
Цікаві факти про протонне число
- 🔢 Найвище відоме Z у 2025 році – 118 для оганесону, синтезованого в Дубні, Росія, але вчені прогнозують “острів стабільності” біля Z=120, де елементи можуть жити довше, ніж частки секунди.
- 🌟 У Великому Вибуху утворилися елементи з Z=1 (водень) і Z=2 (гелій), що становлять 98% матерії Всесвіту – протонне число тут буквально будує космос.
- 🧪 Помилка в підрахунку Z призвела до відкриття технецію (Z=43), першого синтетичного елемента в 1937 році, який тепер використовують у медичній діагностиці.
- ⚛️ Протони не вічні: теорія великого об’єднання передбачає їх розпад з періодом напіврозпаду 10^34 років, що робить Z потенційно змінним у далекому майбутньому.
- 💥 У ядерних реакторах Z урана змінюється під час розпаду, перетворюючись на елементи з меншим Z, вивільняючи енергію, еквівалентну мільйонам тонн вугілля.
Ці факти додають шарму протонному числу, перетворюючи суху цифру на захоплюючу історію. Вони показують, як Z переплітається з космосом, технологіями і навіть майбутніми відкриттями, надихаючи вчених на нові експерименти.
Типові помилки в розумінні протонного числа та як їх уникнути
Багато хто плутає протонне число з масовим, думаючи, що Z визначає вагу атома. Насправді Z – про ідентичність, а A – про загальну масу. Наприклад, студенти часто вважають, що всі атоми з Z=1 ідентичні, забуваючи про дейтерій (водень-2) з нейтроном. Щоб уникнути, завжди пам’ятайте: Z фіксує елемент, N додає варіації.
Інша помилка – ігнорування ролі Z в іонах. У реакціях, як у акумуляторах, зміна електронів не торкається Z, але впливає на заряд. Порада: вивчайте періодичну таблицю з прикладами, як калій (Z=19) у бананах, щоб концепція ожила. А в фізиці не плутайте Z з зарядом ядра – воно завжди +Z, але нейтрони додають масу без заряду.
Сучасні застосування та майбутнє протонного числа
У 2025 році протонне число революціонізує нанотехнології. Елементи з контрольованим Z формують квантові точки для екранів, де Z=48 (кадмій) дає яскраві кольори. У екології, вивчення Z в ізотопах допомагає відстежувати забруднення, як вуглець-13 для аналізу CO2. Майбутнє обіцяє синтез елементів з Z>118, можливо, для нових матеріалів, стійких до екстремальних умов.
А в астрофізиці Z пояснює еволюцію чорних дір, де важкі елементи з високим Z утворюються в наднових. Це ніби космічний коваль, що кує золото з зіркових ядер. З такими перспективами протонне число продовжує надихати, роблячи науку нескінченною пригодою.











Залишити відповідь