Кисень — хімічний елемент з атомним номером 8 і символом O, один з найпоширеніших у Всесвіті та на Землі. У повсякденному житті ми знаємо його як безбарвний газ O₂, що заповнює 21% повітря навколо нас, без запаху й смаку, але з неймовірною силою підтримувати горіння. Цей газ не запалюється сам по собі, зате перетворює звичайний вогонь на справжній вир енергії, роблячи полум’я інтенсивнішим і гарячішим.
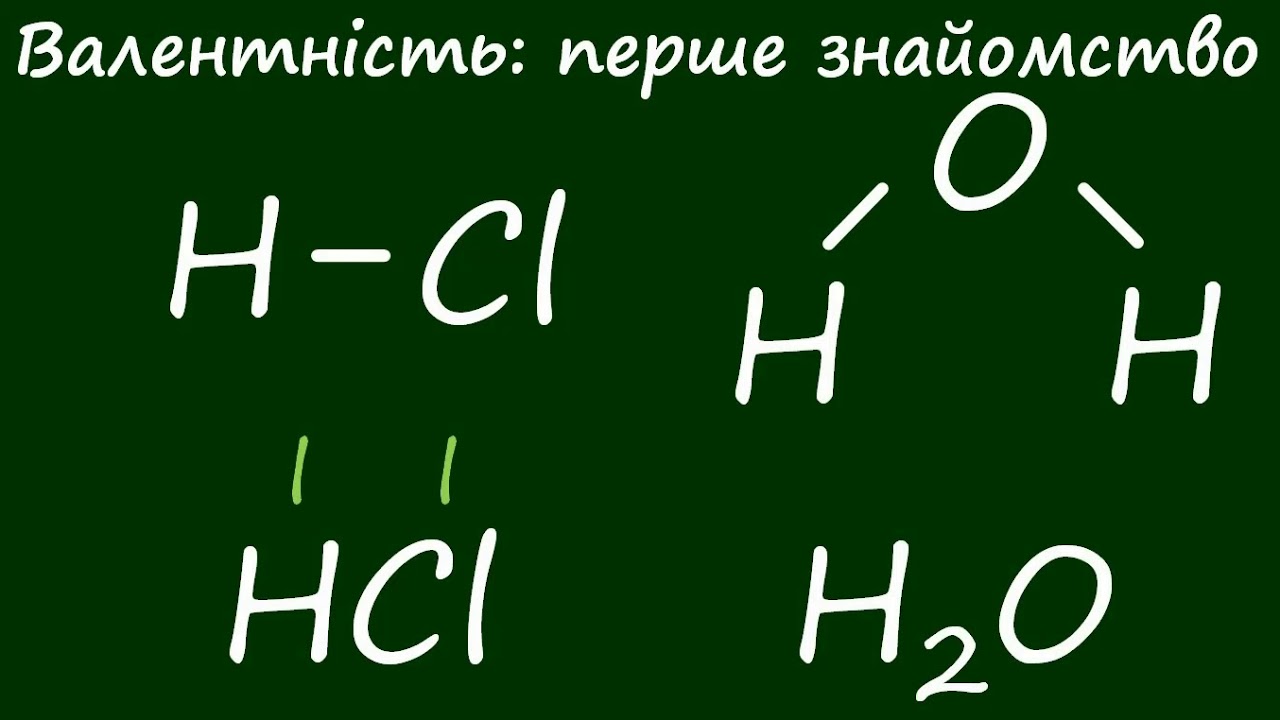
Молекула кисню складається з двох атомів, пов’язаних подвійним зв’язком, що робить її стабільною за кімнатної температури, але жадібною до реакцій при нагріванні. Уявіть: кожен вдих наповнює ваші легені цим невидимим еліксиром, який клітини перетворюють на енергію для бігу, думок чи просто серцебиття. Без нього аеробне життя, як наше, просто згасло б, як вогник без подиху.
Та кисень — не просто газ для дихання. Він ховається в кожній краплі води (де займає 89% маси), у скелях земної кори (майже половина їхньої ваги) і навіть у вашому тілі (65% маси). Тепер зануримося глибше в його таємниці, від атомної будови до ролі в космічних польотах.
Фізичні властивості кисню: від газу до кришталю
За нормальних умов кисень поводиться як грайливий, але непомітний гість: газова форма O₂ прозора, не має ні смаку, ні аромату, з густиною 1,429 г/л при 0°C — трохи важча за повітря (1,293 г/л), тож у закритих приміщеннях може осідати внизу. Розчинність у воді скромна — лише 0,04 г на літр при 20°C, але цього вистачає рибам і водоростям для виживання.
Знижуйте температуру — і відбувається магія. При -183°C (90,18 K) газ стискається в рідину блідо-блакитного відтінку, наче кришталевий еліксир з фантастики, а при -218,8°C (54,36 K) замерзає в сніжно-білі кристали. Рідкий кисень парамагнітний: магніт притягує його, бо неспарені електрони в молекулі створюють магнітний момент — рідкісна риса для газів.
Ці переходи фаз не просто курйоз: вони критичні для промисловості. Рідкий кисень (LOX) зберігають у ізольованих ємностях, бо випарується миттєво. Варіюючи тиск і температуру, інженери керують його поведінкою, від охолодження до вибухової сили в ракетах.
| Стан | Температура плавлення/кипіння | Колір | Густина (г/см³) |
|---|---|---|---|
| Газ (O₂) | – | Безбарвний | 0,001429 (г/л) |
| Рідина | Кипить при -183°C | Блакитний | 1,141 |
| Твердий | Плавиться при -219°C | Білий/блакитний | 1,426 |
Таблиця базується на даних з uk.wikipedia.org. Ці властивості роблять кисень ідеальним для криогенних технологій, де точний контроль стану — ключ до успіху.
Хімічні властивості кисню: сила окисника
Кисень — чемпіон серед окисників, реагує з майже всіма елементами, крім благородних газів як гелій чи неон. При нагріванні металеве залізо спалахує в ньому іскрами, утворюючи окалину Fe₂O₃, а фосфор вибухає синім полум’ям. Навіть лід горить у чистому кисні, перетворюючись на пару й окис вуглецю — ефект, що вражав перших хіміків.
Реакції кисню екзотермічні, виділяють тепло, що прискорює процеси. Утворює оксиди (MeO), пероксиди (Na₂O₂) чи супероксиди (KO₂). З органічними сполуками — горіння з CO₂ і H₂O. Ця активність пояснюється електронною будовою: шістьма валентними електронами на зовнішній оболонці, що прагнуть доповнити пару.
- З металами: 4Li + O₂ → 2Li₂O — блискавичне горіння, як у феєрверках.
- З неметалами: C + O₂ → CO₂ — основа дихання й енергії.
- З воднем: 2H₂ + O₂ → 2H₂O — вибухова суміш, відома як “гремлінгова суміш”.
Після списку видно: без каталізаторів чи іскри кисень пасивний, але розпалений — нестримний. Це дуалізм робить його безпечним у повітрі, але небезпечним у концентраті — звідси правила безпеки в лабораторіях.
Історія відкриття кисню: від алхіміків до революції
Шведський аптекар Карл Вільгельм Шееле першим у 1771-1772 роках нагрів нітрат калію й перманганат, виділивши “вогненне повітря”. Та публікація запізнилася. У 1774-му Джозеф Прістлі, англійський пастор-хімік, нагрів ртутний оксид у колбі над водою — і зібрав газ, що “покращував горіння”. Він вдихнув його сам, відзначивши солодкуватий присмак.
Француз Антуан Лавуазьє, “батько хімії”, у 1775-му повторив експеримент, довів, що газ — п’ята частина повітря, і назвав його “oxygenium” — “кислотоутворювач”, бо вважав основою кислот. Згодом зрозумів помилку, але назва прижилася. Ці відкриття зруйнували флогістонну теорію, запустивши сучасну хімію.
У XIX столітті кисень стали виробляти промислово, а в XX — використовувати в медицині та війні. Сьогодні, станом на 2026, його роль у біотехнологіях і космосі лише зростає.
Поширення кисню в природі: скрізь і ніде
Кисень домінує: 47% маси земної кори у вигляді оксидів силікатів, 50% у осадових породах. У гідросфері — 85,8% маси води H₂O. Атмосфера: 20,95% за об’ємом, 23,15% за масою. У біосфері — 65% маси людського тіла (в H₂O, білках, жирах), 72% у рослинах.
| Середовище | Масовий відсоток кисню | Об’ємний відсоток (для газів) |
|---|---|---|
| Земна кора | 46-47% | – |
| Гідросфера (вода) | 88,8% | – |
| Атмосфера | 23,2% | 21% |
| Людське тіло | 65% | – |
Дані з britannica.com. Люди щороку вдихають 6 мільярдів тонн кисню — і він відновлюється фотосинтезом.
Кисень у біології та медицині: від дихання до терапії
У клітинах кисень — ключ до АТФ, енергії життя: глюкоза + O₂ → CO₂ + H₂O + енергія. Фотосинтез рослини обертає процес: CO₂ + H₂O + світло → глюкоза + O₂. Велике оксидне подія 2,4 мільярда років тому, спричинене ціанобактеріями, наповнило атмосферу O₂, дозволивши еволюцію складних організмів.
У медицині кисневі маски рятують при гіпоксії, HBOT (гіпербарична оксигенація) лікує рани, інфекції, навіть пост-COVID. Станом на 2026, портативні концентратори — тренд для хронічних хворих. Але надлишок токсичний: гіпероксія пошкоджує легені вільними радикалами.
- Дихальна терапія: 100% O₂ при апное.
- Декоративне збагачення: акваріуми, ферми.
- Спорт: кисневі бари для атлетів, хоч докази сумнівні.
Баланс критичний: дефіцит — задуха, надлишок — стрес для клітин.
Промислове виробництво та застосування кисню
90% кисню — фракційна перегонка повітря: охолоджують до -196°C, розділяють за температурами кипіння. Решта — електроліз води. Світове виробництво перевищує 1 мільярд тонн щороку, з фокусом на “зелені” методи з водню.
Металургія жере 60%: у домнах дме кисневий струмінь, прискорюючи виплавку сталі. Зварювання — ацетилен+ O₂ дає 3500°C. Харчова промисловість: окислення спирту в оцет. Навіть акваріуми: насичувачі для риб.
Екологія: забруднення зменшує розчинений O₂ у річках, викликаючи “мертві зони”.
Кисень у космосі: паливо для зірок
SpaceX Starship у 2025-2026 роках використовує LOX + метан: 1200 тонн рідкого кисню на запуск, що штовхає ракету до орбіти. NASA Artemis покладається на LOX для SLS. У космосі O₂ з електролізу води — порятунок астронавтів.
Полярне сяйво: атоми кисню світяться зеленим (557 нм) чи червоним (630 нм) від сонячного вітру.
Озон: третя форма кисню
O₃ — блакитний газ, важчий за повітря, з різким запахом. У стратосфері (озоновий шар) поглинає 99% UV-B, захищаючи життя. Станом на 2026, шар відновлюється завдяки Монреальському протоколу — озонова діра над Антарктидою зменшилася на 20% з 1990-х.
На Землі озон дезінфікує воду, але в приземному шарі — сміг, подразнює легені.
Цікаві факти про кисень
- Фітопланктон океанів виробляє 50-85% атмосферного O₂ — океан дихає за нас!
- Рідкий кисень притягується магнітом, як залізо, через парамагнітність.
- “Темний кисень” утворюється на дні океану без світла — бактерії на електродах (відкриття 2024).
- Людство вдихає 6 млрд тонн O₂ щороку, але рослини повертають удвічі більше.
- У Сонці кисень — 3-й за поширеністю елемент після H і He.
- Ви не уявите: сталь горить у кисні яскравіше за магній!
Ці перлини показують, як кисень грає в приховані ігри з реальністю.
Кисень пов’язує все: від перших бактерій до марсіанських мрій. У забруднених містах його бракує, у лісах — рясніє. Садіть дерева, дихайте глибоко — і відчувайте цей невидимий потік, що пульсує в усьому живому.













Залишити відповідь