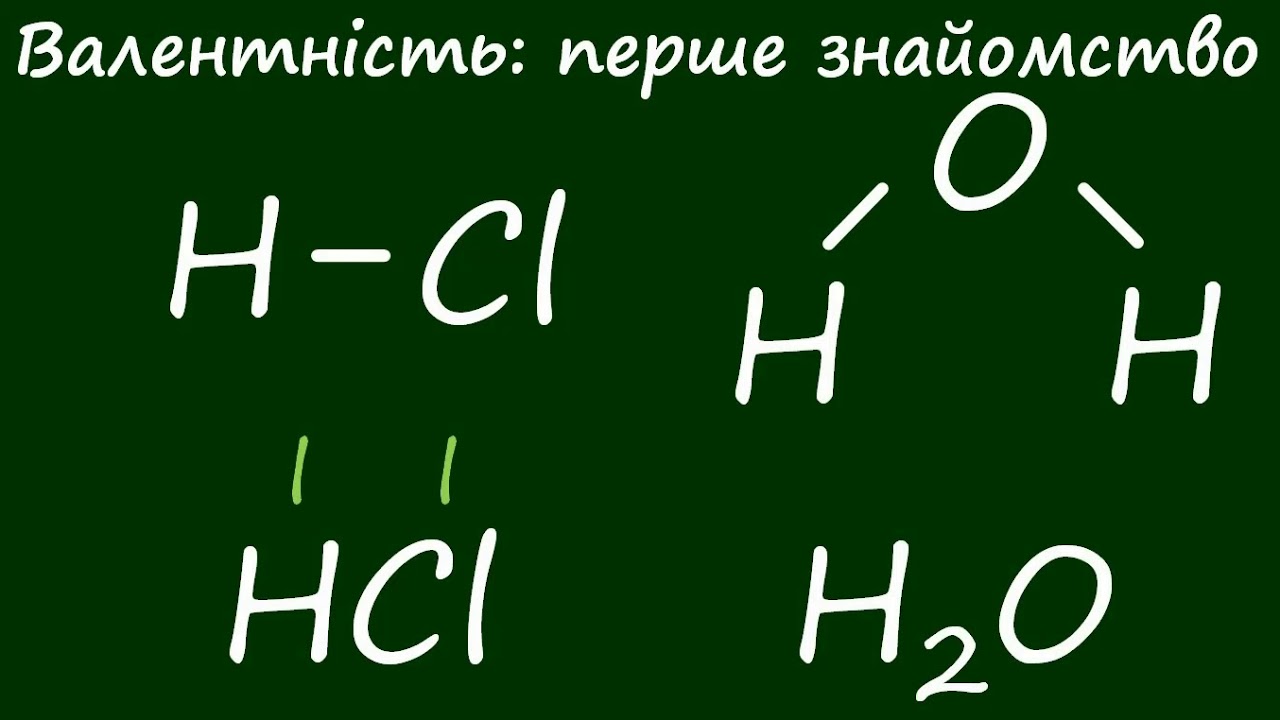
Спирти – це органічні речовини, де гідроксильна група -OH чіпляється безпосередньо до вуглецевого атома, ніби невидимі гачки, що роблять їх унікальними. Найвідоміший етанол дарує радість у келиху вина чи пива, а метанол тихо працює в паливних елементах автомобілів. Ці сполуки оточують нас скрізь: від дезінфекторів на кухні до антифризів у гаражі, поєднуючи простоту будови з неймовірною універсальністю.
Уявіть ланцюг вуглецю, де один водень замінено на -OH – ось і весь секрет. Вони утворюють гомологічний ряд з формулою CₙH₂ₙ₊₁OH для насичених одноатомних, де кожен наступний член більший на -CH₂-, ніби сходинки драбини від метанолу до гігантських вищих спиртів. Ця група визначає все: від запаху свіжого яблучного сидру до вибухової сили в двигунах.
Але не всі спирти дружні – метанол, наприклад, смертельно токсичний у мінімальних дозах, перетворюючись у тілі на отруйний формальдегід. Розуміння їхньої суті рятує життя і відкриває двері до інновацій, як біоетанол, що годує планету чистим паливом.
Історія спиртів: шлях від давніх бродінь до синтетичних чудес
Тисячоліттями людство пило етанол, не підозрюючи про його хімію. Археологи знаходять сліди ферментації з 8000 р. до н.е. у Китаї та Близькому Сході, де фрукти й мед перетворювалися на “божественний напій”. Араби в VI-VII ст. вдосконалили дистиляцію вина, отримуючи міцніший продукт, а слово “алкоголь” походить від арабського “аль-кухуль” – тонкий порошок, яким покривали повіки.
У Європі XII ст. монахи в Італії варили аква вітае – “воду життя”, переганяючи вино. Роберт Бойль у 1660 р. вперше зневоднив етанол, відкривши його як пальне. Російський хімік Т.Є. Ловіц у 1796 р. створив абсолютний спирт, а в 1842 р. німець Я.Г. Шіль помітив гомологічний ряд спиртів. Синтетична ера почалася з Марселя Бертло: етанол з етилену (1854), метанол з хлорметану (1857), ізопропанол з пропену (1855).
Сьогодні синтез еволюціонував до зелених методів – ферментація кукурудзи чи целюлози для біоетанолу, гідратація олефінів на заводах. Ця історія нагадує еволюцію: від випадкового бродіння до контрольованого синтезу, що годує промисловість.
Будова та класифікація: як розібратися в родині спиртів
Серце спирту – гідроксильна група -OH, приєднана до sp³-гібридизованого вуглецю. Без неї це просто вуглеводень, з нею – магія реакцій. Класифікація йде за кількістю -OH: одноатомні (R-OH, етанол), двоатомні (діоли, етиленгліколь HO-CH₂-CH₂-OH), багатоатомні (гліцерин з трьома -OH).
За структурою ланцюга: насичені (від алканів), ненасичені (з подвійними зв’язками), ароматичні (бензиловий спирт C₆H₅CH₂OH). Ключовий поділ – за типом вуглецю з -OH: первинні (R-CH₂-OH, легше окислюються до альдегідів), вторинні (R₂CH-OH, до кетонів), третинні (R₃C-OH, стійкі, але розпадаються за жорстких умов).
Ізомерія додає шарму: для C₄H₁₀O чотири ізомери – н-бутанол (первинний), сек-бутанол (вторинний), ізобутанол (первинний), трет-бутанол (третинний). Назви за ІЮПАК: обираємо найдовший ланцюг, нумеруємо від -OH, суфікс -ол (етанол – етан-ол).
| Тип спирту | Приклад | Формула | Реакція окиснення |
|---|---|---|---|
| Первинний | Етанол | CH₃CH₂OH | → альдегід → кислота |
| Вторинний | Ізопропанол | (CH₃)₂CHOH | → ацетон |
| Третинний | Трет-бутанол | (CH₃)₃COH | Стійкий, розрив ланцюга |
Джерела даних: uk.wikipedia.org (розділ “Спирти”). Ця таблиця показує, як структура диктує долю: первинні – жертви окисників, третинні – бунтарі. Розуміння класифікації – ключ до передбачення поведінки в реакціях.
Фізичні властивості: водневі зв’язки як невидимі нитки
Спирти вирізняються високими температурами кипіння завдяки водневим зв’язкам: -OH притягує сусідні молекули, ніби магніти. Етанол кипить при 78°C, тоді як пропан (аналогічна маса) – мінус 42°C. Нижчі homologи (до C₁₁) – леткі рідини з фруктовими чи спиртовими запахами, вищі – воски чи тверді речовини.
Густина нижча за воду (етанол 0,789 г/см³), вони плавають на поверхні. Розчинність у воді падає з ростом ланцюга: метанол і етанол змішуються всюди, бутанол – лише частково. Ви не повірите, але етанол утворює азеотропну суміш з водою (95,6%), ускладнюючи отримання чистого.
- Леткість: метанол (Ткип 65°C) – швидкий випаровувач для фарб.
- Гігроскопічність: поглинають вологу, ідеально для антифризів.
- Смак і запах: етанол м’який, метанол різкий, гліцерин солодкий.
Ці властивості роблять спирти королями розчинників: етанол розчиняє жири, лаки, смоли. У повсякденні – від парфумів до мийних засобів.
Хімічні властивості: реакції, що оживають молекули
Гідроксил поводиться двояко: як слабка кислота чи основа. З натрієм етанол шипить, виділяючи водень: 2C₂H₅OH + 2Na → 2C₂H₅ONa + H₂ – реакція для первинних і вторинних. Дегідратація з H₂SO₄ при 140°C дає етери (2C₂H₅OH → (C₂H₅)₂O + H₂O), при 170°C – алкени (C₂H₅OH → C₂H₄ + H₂O).
Окиснення – драма: первинні до альдегідів (CH₃CH₂OH → CH₃CHO), потім кислот; вторинні до кетонів ((CH₃)₂CHOH → (CH₃)₂CO); третинні тримаються, доки не розірве ланцюг. Етерифікація з кислотами: CH₃CH₂OH + CH₃COOH → CH₃COOCH₂CH₃ + H₂O – етилацетат для ароматизаторів.
- Горіння: C₂H₅OH + 3O₂ → 2CO₂ + 3H₂O – чисте полум’я.
- З галогеноводнями: утворюють галогеналкіли, первинні легше.
- З металами: тільки активні, як Na, K.
Ці реакції – основа синтезу: від пластмас до ліків. Механізм дегідратації нагадує танець – карбокатіон мігрує, обираючи стабільніший алкен за правилом Зайцева.
Цікаві факти про спирти
Світове виробництво етанолу сягнуло 180 млрд л у 2021 р., здебільшого як біопаливо – еквівалент 10% бензину в США. Гліцерин рятує від спраги: солодкий, його 10% у біодизелі. Метанол – “деревний спирт”, бо історично з деревини, тепер з CO + H₂. Ви не уявите: етанол як антидот при отруєнні метанолом, блокуючи ферменти!
Джерело: uk.wikipedia.org (розділи “Етанол”, “Спирти”).
Отримання спиртів: від природи до лабораторій
Ферментація – найдавніший шлях: дріжджі перетворюють глюкозу на етанол (C₆H₁₂O₆ → 2C₂H₅OH + 2CO₂), до 15% у вині. Промислово: гідратація етилену (C₂H₄ + H₂O → C₂H₅OH, каталізатор H₃PO₄), метанол з синтез-газу (CO + 2H₂ → CH₃OH, 200-300°C, Cu-каталізатор).
Вищі спирти – гідрування жирних кислот або окиснення алканів (Shell-процес). Біоетанол б’є рекорди: Бразилія з тростини, США з кукурудзи, прогноз 200+ млрд л до 2026 р. Лабораторно: гідроліз галогеналкілів (CH₃Br + NaOH → CH₃OH), відновлення карбонілів (LiAlH₄).
Зелені тренди: целюлозний етанол з відходів, ферменти для ефективності. В Україні модернізують заводи на буряках, експорт до ЄС росте.
Застосування: спирти як універсальні помічники
Етанол – зірка: 85% у паливі (E10 – 10% у бензині), розчинник у фарбах, антисептик (70% – ідеал проти вірусів). Метанол – формальдегід для пластмас, паливо М85. Ізопропанол чистить екрани, гліцерин зволожує крем, етиленгліколь морозостійкий антифриз.
У медицині: пропіленгліколь у сиропах, бутилові в лаках. Косметика: цетиловий спирт емульгує. Промисловість: синтетичні мийні засоби з вищих спиртів. Біопаливо скорочує CO₂ на 70% порівняно з бензином – ключ до 2030 р.
| Спирт | Ткип, °C | Застосування | Токсичність |
|---|---|---|---|
| Метанол | 64,7 | Паливо, розчинник | Летальна 7-8 мл |
| Етанол | 78,3 | Паливо, напої, медицина | Низька, 0,4% у крові – смерть |
| Гліцерин | 290 | Косметика, вибухівка | Безпечний |
Таблиця ілюструє різноманітність. Джерело: uk.wikipedia.org.
Спирти проникають у кожен куточок життя, від екологічного палива до порятунку від бактерій, обіцяючи нові відкриття в біохімії та енергетиці.













Залишити відповідь