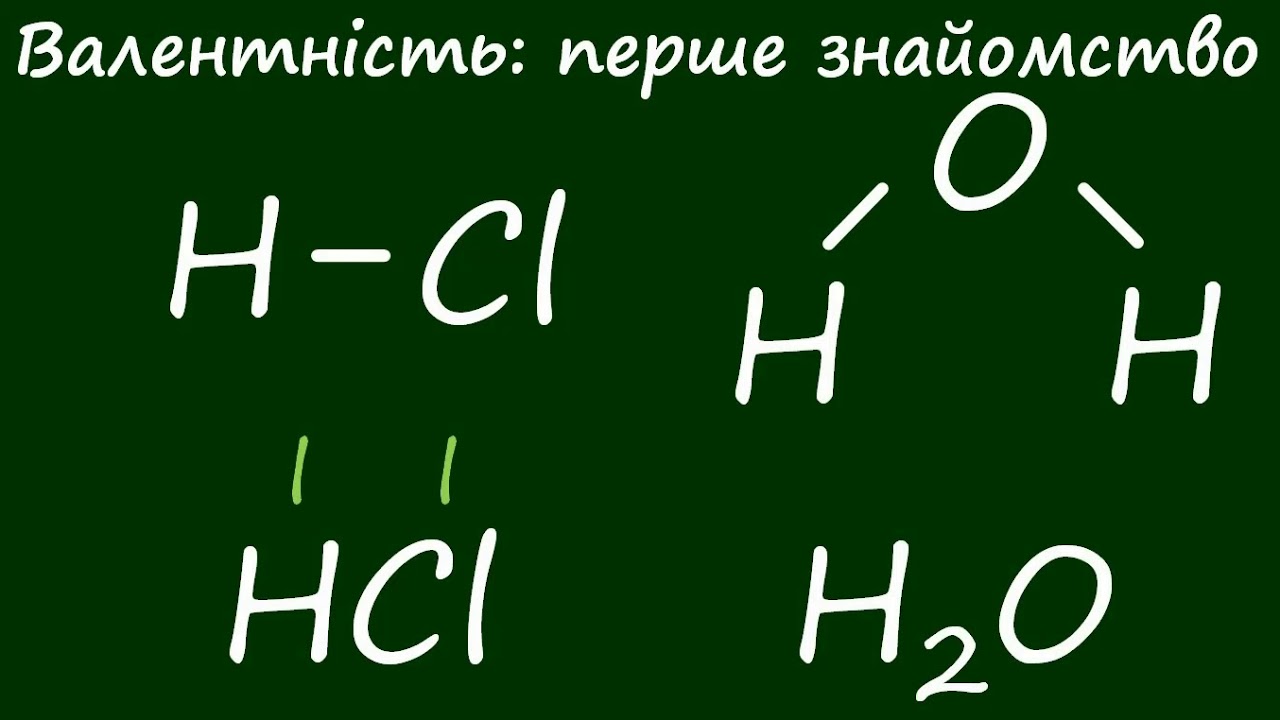
Атоми водню в молекулі води чіпляються за кисень, ніби друзі на гірській стежці тримаються за руки, утворюючи два міцні зв’язки. Валентність — це саме та здатність атома елемента утворювати певну кількість хімічних зв’язків з іншими атомами, визначаючи, скільки “рук” він простягає для партнерства. Ця властивість лежить в основі кожної молекули, від простої води до складних білків у нашому тілі. Водень завжди одновалентний, кисень — двовалентний, а от залізо може грати ролі від двовалентного до шестивалентного, додаючи хімії непередбачуваності.
Уявіть будинок з Lego: валентність показує, скільки цеглинок може з’єднати одна деталь. Без неї атоми блукали б самотньо, не утворюючи ні води, ні солі, ні навіть повітря, яким ми дихаємо. Цей ключовий параметр пояснює, чому вуглець стає основою життя, а фтор — агресивним сусідом.
Розбираючись глибше, побачимо, як валентність еволюціонувала від емпіричних спостережень до квантових моделей, дозволяючи хімікам прогнозувати реакції з точністю годинника.
Історія валентності: від алхіміків до Менделєєва
Уявіть XIX століття, коли хіміки ламали голову над формулами органічних сполук. Британський учений Едвард Франкленд у 1852 році першим ввів термін “валентність”, помітивши, що вуглець у спиртах і кислотах завжди з’єднується з чотирма іншими атомами, ніби має фіксовану “місткість”. Ця ідея вибухнула, як ланцюгова реакція: Ньюлендс використав її для “октави” елементів, а Дмитро Менделєєв закріпив у періодичній таблиці, де номер групи часто дорівнює максимальній валентності.
Раніше, у 1780-х, Лавуазьє рахував атоми в окислах, але без поняття валентності це було сліпе пальцювання. Франкленд же побачив закономірність: металеві елементи в солях поводяться стабільно, а неметали — гнучко. До 1860-х Бутлеров розвинув теорію структури, де валентність стала основою графічних формул. Цікаво, що без цієї концепції не було б органічної хімії як науки — мільйони сполук просто не мали б логіки.
У XX столітті Гілберт Льюїс у 1916 році пов’язав валентність з октетом електронів: атоми прагнуть восьми електронів на зовнішній оболонці, ділячись або віддаючи їх. Це пояснило змінну валентність перехідних металів, як у комплексах платини в протиракових препаратах. Сьогодні, у 2026 році, квантова хімімія уточнює модель, але класична валентність лишається фундаментом шкільних підручників і лабораторій.
Визначення валентності: прості правила для щоденного використання
Валентність вимірюється числом зв’язків, які атом утворює, приймаючи водень за одиницю — він завжди з’єднується з одним атомом. У HCl хлор одновалентний, бо замінює один H. У H₂O кисень двовалентний, тримаючи два H. Ця логіка працює для бінарних сполук: сума валентностей елементів кратна одиницям, як у NH₃ (азот тривалентний) чи CH₄ (вуглець чотиривалентний).
Щоб визначити, візьміть формулу і скористайтеся трьома правилами. По-перше, за воднем у гідридах: у PH₃ фосфор тривалентний (три H). По-друге, за киснем у оксидах: у SO₂ сірка чотиривалентна (O=II, два O дають 4). По-третє, періодична таблиця: максимальна валентність = номеру групи для s,p-блоків (Cl у VII групі — VII), мінімальна для неметалів = 8 – група (Cl=1).
Перед таблицею з прикладами зауважте: ці методи дають емпіричну валентність, ідеальну для початківців. Для складних молекул потрібні структурні формули, де риски показують зв’язки.
| Елемент | Типові валентності | Приклади сполук |
|---|---|---|
| Водень (H) | I | HCl, H₂O |
| Кисень (O) | II | H₂O, CO₂ |
| Вуглець (C) | II, IV | CO, CH₄ |
| Залізо (Fe) | II, III | FeCl₂, FeCl₃ |
| Хлор (Cl) | I, III, V, VII | HCl, Cl₂O, ClO₂, Cl₂O₇ |
Дані з uk.wikipedia.org та Глосарій термінів з хімії (2008). Таблиця спрощує, але ігнорує нюанси комплексів — там валентність може “зрости” за рахунок донорних зв’язків.
Постійна валентність проти змінної: хто як поводиться в реакціях
- Постійна валентність: Надійні партнери, як H (I), O (II), F (I), Al (III). Вони не змінюють “кількість рук” у сполуках — натрію завжди вистачає однієї для NaCl. Це спрощує передбачення: у будь-якому оксиді алюміній тривалентний, Al₂O₃.
- Змінна валентність: Авантюристи, як Fe (II/III у іржі та гемоглобіні), Cu (I/II у монетах і дротах). Причина — d-електрони перехідних металів, що дозволяють різні конфігурації.
- Винятки: Кисень рідко VI (у пероксидах -I), вуглець II у CO, але IV у житті.
Після списку уявіть: змінна валентність робить хімію динамічною, як актор у різних ролях. У батареях літій стабільний (I), а марганець коливається від II до VII, забезпечуючи енергію смартфонам. Для початківців запам’ятайте: головні групи — максимум = група, побічні — варіативно.
Валентність у теоріях хімічного зв’язку: від Льюїса до квантової ери
Льюїс намалював точки електронів: валентні електрони (зовнішні s,p) визначають валентність. Вуглець з 4 валентними e⁻ утворює 4 зв’язки. Теорія валентних зв’язків (VB, Гайдлбергер 1927) додає гібридизацію: sp³ у CH₄ робить тетраедр, ідеальний для ДНК.
Правило октету (8 e⁻) пояснює більшість: Ne стабільний, без валентності. Винятки — розширений октет (SF₆, S=VI) чи неповний (BF₃, B=III). Сучасна молекулярно-орбітальна теорія (MO) бачить валентність як заповнення bonding орбіталей, точніше для металів.
У 2026 році комп’ютерне моделювання DFT прогнозує валентність у суперматеріалах, як графен (C=III) чи MOFs з змінними металами для каталізу CO₂ у паливо.
Валентність, ступінь окиснення та координаційне число: розбираємо плутанину
Ці терміни часто змішують, але вони різні світи. Валентність — кількість зв’язків, ступінь окиснення (СО) — умовний заряд (якби зв’язок іонний), координаційне число (КЧ) — ligands навколо центра в комплексах.
| Поняття | Визначення | Приклад |
|---|---|---|
| Валентність | Кількість ковалентних зв’язків | Fe у FeCl₃ — III |
| Ступінь окиснення | Умовний заряд атома | Fe +3 |
| Коорд. число | Лігандів навколо центра | [Fe(H₂O)₆]³⁺ — 6 |
У FeCl₃ валентність=СО=III, але в [Fe(CN)₆]⁴⁻ КЧ=6, СО=-II. Дані з uk.wikipedia.org. Розуміння різниці рятує від помилок у назвах, як FeCl₂ — хлорид заліза(II).
Цікаві факти про валентність
Ви не повірите, але вуглець з валентністю IV будує 10⁵⁰ органічних молекул, включаючи кофеїн у вашій каві. Залізо в гемоглобіні перемикає валентність II↔III для транспорту кисню — без цього ми б не бігали марафони.
- У 2025 році вчені синтезували стабільний Pb(IV) у перовскітах для сонячних панелей, перевершивши класичні Pb(II).
- Фулерен C₆₀ має валентність III для C, утворюючи “футбольний м’яч” — нобелівський приз 1996.
- У супертяжких елементах, як оганесон (118), валентність падає до 0 через релятивістські ефекти — атоми “ліниві”.
Ці перлини показують, як валентність оживає в нанотехнологіях і медицині.
Застосування валентності: від ферментів до батарей майбутнього
У біології валентність — серце ферментів: цинк (II) у карбоангідразі прискорює реакції в 10⁶ разів. Магній (II) у хлорофіллі ловить світло, як зелений магніт. У промисловості змінна валентність Cr(VI/II) у каталізаторі Фішера-Тропша перетворює CO₂ на бензин.
Сучасні тренди 2026: MOFs з Zr(IV) для уловлювання CO₂, валентність Cu(I/II) у суперконденсаторах для електрокарів. Типова помилка новачків — ігнор гібридизації, але з нею ви прогнозуєте геометрію молекул, як у VSEPR для NH₃ (пірамідальна через III валентність).
Експериментуйте: змішайте FeSO₄ з KSCN — червоний колір видасть Fe(III). Валентність не абстракція, а інструмент, що формує світ навколо.













Залишити відповідь